Выращивание поджелудочной железы из стволовых клеток
Ученые вырастили работающую поджелудочную железу
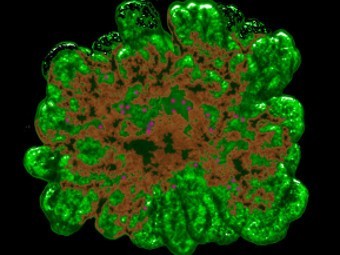
Группа ученых из университета Копенгагена разработала инновационный 3D-метод для выращивания поджелудочной железы из клеток-предшественников. По словам авторов, опубликовавших свою работу в журнале Development, в будущем этот способ может помочь при тестировании антидиабетических лекарственных средств и создании биоинженерной поджелудочной железы.
Как отмечают ученые, предыдущие исследования показали возможность производства предшественников клеток поджелудочной железы, однако попытки размножить их и дифференцировать в бета-клетки, продуцирующие инсулин, оказывались безуспешными.
Исследователи создали уникальную технологию, которая позволяет эффективно наращивать клетки поджелудочной железы мышей в трехмерной гелевой среде. Разработанный метод имеет большой потенциал для производства миниатюрных поджелудочных желез из стволовых клеток человека. Такие мини-версии органов, как считают ученые, будут полезны в качестве модели для исследования эффектов новых лекарств, причем без необходимости тестирования препаратов на животных.
Согласно данным проведенных исследований, для образования такого мини-органа необходимо, чтобы хотя бы четыре клетки поджелудочной железы были расположены рядом друг с другом. По словам ученых, при оптимально подобранных условиях начальные комплексы из нескольких клеток размножаются до 40 тысяч за одну неделю.
«После периода активного роста клетки такого органоида преобразуются, приобретая способность производить пищеварительные ферменты или гормоны, такие, как инсулин, и самоорганизуются в разветвленную сеть островков, которые удивительно похожи на систему поджелудочной железы», — процитировал Science Daily слова профессора Энн Грэпин-Боттон (Anne Grapin-Botton), ведущего исследователя.
По мнению авторов, этот метод является важным этапом на пути к производству бета-клеток для лечения сахарного диабета первого типа, так как с его помощью станет возможным тестировать экспериментальные противодиабетические препараты без экспериментов над животными и выращивать биоинженерные комплексы клеток для пересадки пациентам, в организме которых не вырабатывается инсулин. Ученые собираются продолжить свою работу и адаптировать этот метод для стволовых клеток человека.
Заменитель поджелудочной железы можно вырастить в пробирке
Увенчались успехом эксперименты по выращиванию островков поджелудочной железы вместе с сосудами прямо «в пробирке». Это открытие принципиально важно для успешной трансплантации островковых клеток поджелудочной железы при диабете I типа.
Национальный научный фонд (National Science Foundation) профинансировал многоуниверситетское исследование под руководством ученых из Школы инженеров Свансона Университета Питтсбурга (University of Pittsburgh Swanson School of Engineering), которые изучают использование плюрипотентных стволовых клеток человека (hPSC) для создания островков поджелудочной железы в лаборатории. Основной целью исследования является разработка метода выращивания васкуляризационных островков in vitro, в пробирке, что, по мнению исследователей, приведет к повышению жизнеспособности островковых клеток и усилению их функции после трансплантации.
«Это первая удачная попытка создать in vitro васкуляризированные органоиды — островки поджелудочной железы из hPSCs», — объясняет Ипсита Банерджи (Ipsita Banerjee), руководитель исследования. «Благодаря совместным усилиям мы разработали метод имплантации фрагментов кровеносных сосудов в островки. Путем васкуляризации островков до их трансплантации в организм они с большей вероятностью выживут и могут быстрее регулировать уровень глюкозы в крови».
Что такое островки и почему они жизненно необходимы?
Крошечные скопления клеток, называемые островками Лангерганса, расположены по всей поджелудочной железе, и позволяют органу производить инсулин. Группы таких клеток были обнаружены еще в 1869 ученым Паулом Лангергансом, в честь которого и были названы. Клетки островков концентрированы преимущественно в хвосте поджелудочной железы, и составляют 2% от массы органа. Всего в паренхиме насчитывается около 1 миллиона островков.
Выявлено, что у новорожденных островки занимают 6% от всей массы органа. По мере взросления организма удельный вес структур, имеющих эндокринную активность, снижается. К пятидесяти годам их остается всего 1-2%. В течение суток островки Лангерганса секретируют около 2 миллиграммов инсулина.
Диабет I типа приводит к тому, что иммунная система разрушает эти островки. В результате пациенты должны ежедневно принимать инсулин, чтобы поддерживать уровень сахара в крови. Слишком высокий уровень сахара может приводить к гипергликемии, диабетическому кетоацидозу и, если эти состояния не купировать — к смерти. Пациенты должны самостоятельно регулировать уровень сахара в крови на протяжении всей своей жизни. Либо искать возможность для замены неработающей поджелудочной железы или ее активной части — островков Лангенгарса.
Зачем островкам нужны сосуды?
Островки поджелудочной железы имеют очень высокие потребности в кислороде. При пересадке их нужно как можно скорее «подключить» к сосудам организма-реципиента, иначе они начнут очень быстро терять способность регулировать уровень глюкозы в крови и отмирать. Исследователи начали искать новые методы, чтобы ускорить васкуляризацию островков после трансплантации, и пришли к выводу, что проще «вырастить» сосуды еще до пересадки, в пробирке, прямо внутри группы островковых клеток.
В эксперименте была использована новая структурирующая система — специальный гидрогель для создания трехмерной конфигурации клеточной культуры, которая имитирует способ образования поджелудочной железы естественным путем.
«Гидрогель подобен строительным лесам, и он помогает наращивать ячейки структуры в трехмерном пространстве», — говорит доктор Банерджи. «Обычно плюрипотентные стволовые клетки hPSC представляют собой структуру неконтролируемой конфигурации, однако, используя гидрогель, разработанный нашим сотрудником в штате Аризона, мы можем создать точную многоклеточную архитектуру под названием« сфероиды». В отличие от обычной двумерной культуры островковых клеток, выращенной в чашке Петри, островковые сфероиды, выращенные на гидрогеле, полностью идентичны тем структурам, которые образуются в организме естественным путем».
Кроме применения непосредственно для трансплантации, создание жизнеспособных васкуляризованных островков поджелудочной железы за пределами тела может стать ценным инструментом для проверки эффективности и токсичности новых лекарств для лечения поджелудочной железы. Кроме того, васкуляризация органелл in vitro открывает новые горизонты в области трансплантологии.
«Принципы предварительного проектирования васкуляризации перед трансплантацией может применяться к любому типу ткани, а не только в случае поджелудочной железы», — говорит доктор Банерджи. «Когда донорские островки используются для трансплантации, часть из них гибнет в результате процедуры. Мы ожидаем, что меры, которые мы принимаем в лаборатории до того, как новые клетки будут пересажены в тело пациента, будут иметь огромное значение для регенеративной медицины следующего поколения».
Предшествующие исследования
Попытки стимулировать васкуляризацию островковых клеток в пробирке проводились и раньше. Так, в 2011 году были опубликованы результаты эксперимента американских ученых из Boston University, Brown University, Alpert Medical School , в котором они проверяли предположение, что стволовые клетки костного мозга стимулируют ангиогенез в островках поджелудочной железы. Для проверки этой гипотезы человеческие островки (100 на 1 мл) культивировали отдельно (контроль) или совместно с цельным человеческим костным мозгом (106 клеток на 1 мл) в течение 210 суток. При оценке в конце выращивания было обнаружено, что при ко-культивировании значительно возрастает содержание таких факторов ангиогенеза, как VEGF-a (535 vs 2 pg/mL), PDGF (280.79 vs 0 pg/mL), KGF (939 vs 8 pg/mL), TIMP-1 (4592 vs 4332 pg/mL) и ангиогенина (506 vs 97 pg/mL). При этом содержание ангиопоэтина-2 было ниже, чем в контроле (5 vs 709 pg/mL). Если при ко-культивировании удалить названные проангиогенные факторы, вызванная СК васкуляризация островков также снижается, что говорит о паракринном механизме воздействия этих клеток.
При вызванной стволовыми клетками васкуляризации наблюдалось значительное рассеивание эндотелиальных клеток и рост островков. Те островки, что уменьшались в размере, отличались слабой васкуляризацией. В течение всего периода культивирования наблюдалось выделение инсулина, что говорит о сохранении функции островков при взаимодействии со стволовыми клетками. Более того, при ко-культивировании наблюдалось значительное усиление генной экспрессии инсулина и глюкагона по сравнению с контролем — в 28,66 и в 24,4 раза соответственно. Это свидетельствует о том, что СК стимулируют и регенерацию эндокринных клеток.
Выращивание поджелудочной железы из стволовых клеток
Ученые не первый год бьются над проблемой лечения диабета 1 типа. Но до сих пор, все, что можно предложить пациентам — инъекции инсулина. Были, впрочем, успешные эксперименты с пересадкой донорских островков Лангерганса, производящих инсулин. Но при трансплантации возникает своя проблема — необходимость принимать иммунодепрессанты. И неизвестно еще, что лучше — пожизненные уколы инсулина или пожизненный прием иммунодепрессантов.
Разумеется, было бы хорошо, если бы пациенты получили свои инсулинопроизводящие клетки, но без риска отторжения. На сегодняшний день наука знает только один вариант, который мог бы обеспечить это. И этот вариант связан с плюрипотентными стволовыми клетками.
Немецкие специалисты из Helmholtz Zentrum München взялись за решение задачи. Самое важное было — точно определить путь, который делает стволовые клетки незрелыми клетками поджелудочной железы, а уже затем — бета-клетками, продуцирующими инсулин.
Ученые смогли точно установить, какой сигнал определяет, станут ли клетки поджелудочной железы эндокринными (производящими гормоны), в частности, бета-клетками, или эпителиальными, которые просто выстилают протоки поджелудочной железы.
Исследование показало, что превращение клеток-предшественников полностью зависит от взаимодействия внеклеточного матрикса, находящегося вне клетки, и микрофиламентов цитоскелета, который находится внутри клетки. Особую роль в превращении играли гликопротеины ламинин и фибронектин.
После обнаружения искомого сигнального пути ученые смогли направлять стволовые клетки с помощью небольших ингибирующих молекул, нацеленных на конкретные компоненты идентифицированного пути. Таким образом в лаборатории смогли выращивать бета-клетки поджелудочной из собственных тканей пациента и не опасаться, что организм их отвергнет.
Выращивание поджелудочной железы из стволовых клеток
№02 Февраль 2019
Журнал добавлен в корзину.
Колыбель для поджелудочной железы
Поджелудочную железу для трансплантации можно выращивать в межвидовых химерах.
Гормон инсулин синтезируют особые клетки поджелудочной железы. Если они по какой-то причине гибнут, начинается диабет первого типа: из-за недостатка инсулина наши органы и ткани не могут правильно усваивать глюкозу, уровень сахара в крови повышается, и вслед за нарушенным обменом веществ развиваются серьёзные проблемы со здоровьем. И даже если мы устраним причину, по которой погибли инсулиновые клетки, их нужно как-то восстановить.
Само собой напрашивается, что их можно пересадить, либо вместе с целой поджелудочной железой, либо только сами эти клетки, которые образуют в железе характерные скопления под названием островки Лангерганса. Однако, как и при всякой трансплантации, здесь неизбежно возникают две проблемы: во-первых, нужен донор, во-вторых, нужно постоянно быть готовым к отторжению пересаженной ткани. С отторжением обычно борются, подавляя активность иммунитета специальными препаратами, но тут уже надо быть готовым к тому, что «сонная» иммунная система пропустит инфекцию или рак.
Проблемы отторжения удалось бы избежать, если бы пересаживаемый орган или клетки генетически совпадали с организмом, в который их пересаживают. Откуда же взять такую «вторую копию»? Очевидно, тут нужны стволовые клетки, причём не натуральные эмбриональные, а индуцированные, которые получают искусственным образом при перепрограммировании каких-нибудь зрелых, специализированных клеток. Например, взяв у больного клетки кожи, их можно перепрограммировать в стволовые, чтобы потом из них вырастить орган или ткань на замену испорченной. Однако во многих случаях невозможно сделать то, что требуется, просто на лабораторном столе – чтобы орган или его фрагмент сформировались так, как надо, он должен развиваться в естественной среде, то есть в целом организме.
Некоторое время назад исследователи из Токийского университета вместе с коллегами из Стэнфорда сумели вырастить крысиную поджелудочную железу в организме мыши: мышиные стволовые клетки пересаживали крысам, после чего внутри у крыс вырастал орган, который по генетике был мышиным. Но как удалось избежать отторжения? Дело в том, что иммунной системе в ходе эмбрионального развития нужно время, чтобы научиться отличать «своих» от «чужих». Стволовые клетки пересаживали крысиным эмбрионам, у которых иммунитет ещё только развивался – всё, что иммунная система «видела» вокруг себя в зародыше, она считала «своими», и чужие стволовые клетки, из которых потом получалась поджелудочная, тоже становились для неё «своими».
Железа в итоге получалась крысиная во всём, кроме размера – по величине она была мышиной, и инсулиновых клеток в ней не хватало, чтобы полностью восполнить их недостачу у крысы с диабетом. Тогда исследователи поменяли животных ролями, и таким же способом вырастили в крысе поджелудочную железу мыши. Крыс модифицировали так, чтобы собственная поджелудочная у них не формировалась и не мешала той, что будет расти из мышиных стволовых клеток. В результате в крысах получали железу, которая генетически соответствовала мышам, но по размеру при этом была крысиной – то есть материала для пересадки в ней было более чем достаточно.
В статье в Nature говорится, что пересадки скоплений инсулиновых клеток (а таких скоплений пересадили более сотни) мышам с диабетом, уровень сахара в крови у них приходил в норму, и оставался в норме в течение 370 дней. Поскольку при трансплантации в организм мыши так или иначе попадали крысиные клетки, мышам пять дней после операции давали иммуносуппрессоры, чтобы иммунитет, который неизбежно должен был отреагировать на «чужаков», не вышел из-под контроля. Однако потом иммуносуппрессоры давать переставали, и никакого отторжения не случалось. Когда в конце эксперимента инсулиновые островки Лангерганса извлекали для анализа, то крысиных клеток там не было: иммунитет их выедал, и, выполнив свою задачу, успокаивался – атаковать сами инсулиновые клетки ему резонов не было, так как они генетически не отличались от самой мыши.
Обычно, когда речь идёт о манипуляциях со стволовыми клетками, то непременно упоминают про опасность рака: если такая клетка испортится, она легко может начать формировать злокачественную опухоль. Однако в данном случае никаких признаков онкологических процессов у мышей не было – вероятно, потому, что железа и инсулиновые клетки развивались в эмбрионе (пусть и крысином), то есть в более подходящей для них среде.
Итак, как мы видим, в принципе для выращивания органов можно использовать вообще представителей другого биологического вида. Реально ли проделать ту же процедуру с человеческими клетками и, к примеру, со свиньёй или овцой? Наверно, вполне реально: введя стволовые клетки человека в эмбрион свиньи, мы получим прекрасный материал для пересадки, которые не будет раздражать нашу иммунную систему. Однако прежде чем такой метод войдёт в медицинскую практику, здесь, кроме множества необходимых экспериментов, потребуется уладить ещё и ряд этических вопросов, которые, разумеется, у кого-нибудь неизбежно возникнут.
Автор: Кирилл Стасевич
Читайте также:
Пересаженные инсулиновые клетки защитили от иммунитета
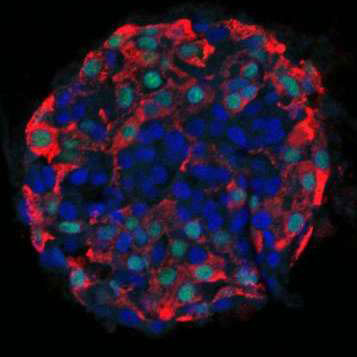 Диабет первого типа можно преодолеть с помощью пересадки новых инсулиновых клеток, защищённых от иммунной агрессии специальной капсулой.
Диабет первого типа можно преодолеть с помощью пересадки новых инсулиновых клеток, защищённых от иммунной агрессии специальной капсулой.
Настоящая поджелудочная железа выросла в пробирке

Биоинженерам из Питтсбурского университета (США) впервые удалось вырастить в лаборатории из человеческих плюрипотентных стволовых клеток кусочек поджелудочной железы с сетью кровеносных сосудов.
По словам авторов, в будущем такие конструкции можно будет пересаживать больным сахарным диабетом 1 типа, чтобы избавить их от постоянных инъекций инсулина и контроля уровня сахара в крови.
Самым основным достижением своей работы авторы считают создание сети кровеносных сосудов, оплетающих клетки поджелудочной железы. Но и выращивание самих клеток поджелудочной железы — так называемых бета-клеток островков Лангерганса – само по себе интересно и заслуживает внимания.
Поджелудочная железа человека состоит из крошечных скоплений бета-клеток – они образуют островки Лангерганса. Они были обнаружены еще в 1869 ученым Паулом Лангергансом, в честь которого и были названы. Клетки островков составляют примерно 2% от массы органа. Всего в паренхиме насчитываются сотни тысяч островков, каждый из которых содержит примерно 200 бета-клеток. Основная функция бета-клеток – производство инсулина — гормона, который контролирует уровень сахара в крови. Одна бета-клетка здорового человека работает с невероятной скоростью и производит примерно миллион молекул инсулина в минуту.
При сахарном диабете 1 типа иммунная система по ошибке начинает атаковать и уничтожать свои собственные клетки – мишенью оказываются как раз бета-клетки поджелудочной железы. В результате они перестают производить инсулин. Поэтому больные должны ежедневно принимать этот гормон, чтобы поддерживать уровень сахара в крови. Слишком высокий уровень сахара также очень опасен — это может приводить к гипергликемии, диабетическому кетоацидозу. Поэтому пациенты вынуждены самостоятельно контролировать и регулировать уровень сахара в крови на протяжении всей своей жизни.
Но поиски методов лечения сахарного диабета продолжаются. Одно из направлений здесь – выращивание из стволовых клеток самого пациента бета-клеток островков Лангеранса, а затем их имплантация в организм.
Такие эксперименты проводятся. Но сложность заключается в том, что бета-клетки плохо приживаются при трансплантации. Все дело в том, что для своей жизни им необходимо большое количество кислорода. Поэтому при пересадке их нужно как можно скорее «подключить» к сосудам организма-реципиента, иначе они просто погибают.
Единственный способ решить проблему, как говорят авторы, это вырастить клетки, уже оплетенные сосудами, до трансплантации. И пересадить в организм уже такой готовый конструкт.
Решить эту задачу авторам нынешнего исследования удалось.
Для этого они использовали особенный гидрогель, в который помещали стволовые клетки, из которых в пространстве 3Д уже и выращивали бета-клетки островков Лангерганса, оплетенные сосудами.
«В своем исследовании мы использовали особый гидрогель – это новая разработка. В него мы помещали плюрипотентные клетки. И их превращали уже во взрослые зрелые специализированные клетки. Все это происходило не в двухмерном пространстве, как это обычно делают в экспериментах в чашках Петри, а в трехмерном – точно так же, как этот процесс идет в организме, когда формируется поджелудочная железа», — говорит ведущий автор исследования Ипсита Банерджи (Ipsita Banerjee).
Причем, добавляет она, такой способ выращивания кровеносных сосудов (или васкуляризация) до имплантации может применяться не только для поджелудочной железы. Но и для любых других органоидов, которые экспериментально выращиваются в лаборатории. Это очень важно, ведь проблема васкуляризации одна из самых сложных в регенеративной медицине.
СМИ: ученые научились выращивать клетки, производящие инсулин

МОСКВА, 9 окт — РИА Новости. Ученые из Гарвардского университета достигли прорыва в лечении сахарного диабета первого типа, научившись выращивать и пересаживать клетки, самостоятельно производящие инсулин, сообщает The Telegraph.
Используя эмбриональные стволовые клетки, ученые смогли создать большое количество инсулин-продуцирующих человеческих клеток, почти полностью идентичных здоровым клеткам поджелудочной железы. Их трансплантация позволит больным диабетом первого типа отказаться от ежедневных инъекций инсулина, уверены исследователи.
Сахарный диабет первого типа – аутоимунное заболевание, при котором так называемые бета-клетки поджелудочной железы перестают вырабатывать гормон инсулин, регулирующий уровень глюкозы в крови. При инъекциях инсулина невозможно абсолютно точно регулировать необходимое количество вводимого гормона, что может привести к осложнениям. Первый тип сахарного диабета менее распространен, чем второй, однако им часто заболевают люди в молодом возрасте.
«Мы сейчас на стадии доклинических испытаний, в шаге от финиша», — цитирует издание профессора Дуга Мелтона, который посвятил этим исследованиям 23 года после того, как у его маленького сына диагностировали диабет.
Выращивание поджелудочной железы из стволовых клеток
Ответ на поступивший к нам вопрос «Какие есть разработки в лечении сахарного диабета первого типа стволовыми клетками?»
Словосочетание «лечение сахарного диабета первого типа стволовыми клетками» пока не имеет практического смысла. Работа не вышла из стадии экспериментов. Суть достигнутого – установление факта, что при определенных условиях стволовые клетки костного мозга или крови эмбрионов человека могут дифференцироваться в клетки, подобные вырабатывающим инсулин бета-клеткам островков Лангерганса поджелудочной железы [1-4 ]. Показано также, что прогениторные клетки из некоторых тканей плодов или взрослых, таких как печень и костный мозг, способны дифференцироваться в нечто похожее на бета-клетки («в клетки, имеющие фенотип бета-клеток»). Есть указания и на то, что предшественниками клеток островков являются невральные стволовые клетки и что из них в культуре тканей могут быть получены клетки со свойствами островковых [5, 6]. Однако автор обобщающей статьи, посвященной проблеме образования вырабатывающих инсулин клеток из стволовых клеток для заместительной клеточной терапии диабета I типа (май 2004 г), S.Efrat смог только заключить, что это «открывает новые пути для выращивания клеток для трансплантации больным диабетом I типа» [3].
Специалисты из Университета Джона Гопкинса M.J. Shamblott и G.O.Clark в статье «Клеточные терапии для сахарного диабета I типа», опубликованной в марте 2004 года в журнале Expert Opin Biol Ther, сделали следующее заключение. «Стволовые клетки костного мозга или крови пуповины согласно недавним исследованиям … обладают способностью дифференцироваться и в бета-клетки поджелудочной железы. Стволовые клетки эмбрионов человека пролиферируют в культуре и присущая им пластичность в отношении будущего развития делает их потенциально неограниченным источником клеток, способных воспринимать уровень глюкозы и вырабатывать зрелый инсулин. Широкий диапазон предложенных источников клеток и проясняющаяся картина развития поджелудочной железы позволяют предположить, что новые клеточные терапии когда то (one day) смогут конкурировать с неклеточным восприятием уровня глюкозы и устройствами для введения инсулина [4]».
Реальным, но очень сложным и чрезвычайно дорогостоящим методом лечения диабета I типа является трансплантация клеток островков Лангерганса. Практическое осуществление метода стало возможным после разработки многих его деталей специалистами университета Альберта в гор. Эдмонтон, Канада (т.е. создания протокола Эдмонтон или Эдмонтонского протокола) [7]. Основными особенностями протокола являются методика выделения островков из поджелудочной железы донора и состав комбинированной иммуносупрессивной терапии.
Только что на 64-й сессии Американской Диабетической Ассоциации (АДА) (6 июня 2004 г) доложены результаты первого международного многоцентрового исследования эффективности трансплантации клеток островков поджелудочной железы по протоколу Эдмонтон, в котором на протяжении 4 лет участвовали 9 центров из США, Канады и Европы [8, 9].
Процедура заключается в пересадке вырабатывающих инсулин клеток поджелудочной железы больным первым типом диабета. Для выделения островков из поджелудочной железы донора используются специальные ферменты (энзимы). Оригинальная методика подготовки островков с высоким выходом клеток создана C.Ricordi из университета Майами. Для каждой трансплантации требуются клетки от одного или нескольких трупов. Так как пересаживаются только клетки, а не вся поджелудочная железа или ее часть, процедура не связана с крупной хирургической операцией. Клетки вводят в воротную вену печени через катетер, устанавливаемый под контролем ультразвука. Клетки задерживаются в печени. где получают кровоснабжение, и начинают реагировать на изменения уровня сахара в крови, выделяя достаточные количества инсулина. Причем реакция трансплантированных клеток на глюкозу появляется практически немедленно и на протяжении первых нескольких недель их функция улучшается.
Важнейшим компонентом протокола Эдмонтон является уникальная комбинация иммуносупрессивных лекарств. Она не направлена на подавление всей иммунной системы человека, а блокирует только специфически иммунные реакции, которые разрушают собственные ткани больного или вызывают отторжение пересаженной ткани. Комбинация включает в себя сиролимус, который позволяет избежать применения стероидных гомонов. Последние токсичны для островковых клеток и способны вызывать устойчивость (резистентность) к инсулину. Другая особенность комбинации – использование малых доз второго компонента – такролимуса, что уменьшает его воздействие на островки. Третий компонент — иммуносупрессивное средство даклизумаб — используется только в течение короткого периода времени непосредственно после трансплантации, чтобы предупредить начальное отторжение.
Через год после трансплантации островков 19 из 36 участников исследования были полностью независимы от инсулина (у них нормальны уровни гликозилированного гемоглобина, глюкозы в покое и после нагрузки). У пяти из этих больных независимость от инсулина была достигнута после одной инъекции, у семи потребовалось 2 или 3 инъекции. Из остальных 17 больных, у которых через год требовалось введение инсулина, у 7 наблюдалось улучшение контролирования диабета, обусловленное, очевидно, частичным функционированием пересаженных клеток.
Включенные в исследование больные были «метаболически лабильны, у них отмечались повторные эпизоды гипогликемии и прогрессировали осложнения диабета несмотря на попытки контроля (best efforts at control). Критерием отбора был вес менее 70 кг и наличие «адекватного почечного резерва», что определялось как клиренс креатинина более 80 мл/мин/1.73 м.
Результаты были лучшими в центрах, уже имевших некоторый опыт трансплантации по Эдмонтонскому протоколу.
Не было случаев смерти, возникновения злокачественных опухолей или развития пострансплантационных лимфопролиферативных состояний. Побочные являения включали в себя нейтропению, диарею и обезвоживание, язвы в полости рта, и эпизод гипогликемии, возникший у больного с нефункционировавшими островками
Основной исследователь проекта отметил, что к настоящему времени близкая методика трансплантации в мире использована более чем у 350 человек.
Авторы сообщения признают, что трансплантация клеток островков — не излечение от диабета, а метод альтернативного лечения, подходящий только некоторым больным с нестабильной формой сахарного диабета первого типа, не поддающейся контролю инъекциями инсулина. Больные, которым осуществлена пересадка клеток островков поджелудочной железы, должны в течение оставшейся жизни принимать иммуносупрессивные лекарства для предупреждения отторжения трансплантированных клеток. Эти лекарства увеличивают риск инфекции и очевидно, некоторых видов рака.
Литература и другие источники информации
Выращивание поджелудочной железы из стволовых клеток

Российские ученые создали инсулинпродуцирующие клетки, позволяющие бороться с сахарным диабетом. Об этом на форуме «Удивительное в российском здравоохранении» заявила министр здравоохранения Вероника Скворцова, сообщает «РИА Новости».
«Мы можем формировать эквиваленты органов и систем органов человека из аутологичных (применяющихся для трансплантации) клеток. Безусловно, прорывом является создание инсулинпродуцирующих клеток, которые при внедрении в кровь человеку с сахарным диабетом второго типа фактически являются заместительной терапией», — сказала Скворцова.
Инсулинпродуцирующие клетки, созданные на основе стволовых клеток, позволяют заместить клетки поджелудочной железы, которые поражает диабет. Благодаря клеткам, люди с сахарным диабетом второго типа смогут отказаться от постоянного введения инсулина.
Изучение инсулинпродуцирующих клеток ведется и в других странах. В мае 2017 года Science Alert писал об исследовании Университета Майами, в рамках которого пациентке с сахарным диабетом первого типа были пересажены инсулинпродуцирующие клетки. Цель исследования заключалась в определении наиболее подходящего места для трансплантации клеток. Пациентке пересадили инсулинпродуцирующие клетки в жировую складку на животе. В результате женщина больше не нуждалась в инъекциях инсулина, а ученые сделали предположение, что именно эта область тела является идеальным местом для трансплантации.
Летом 2017 года The Telegraph писала об исследованиях ученых Гарвардского университета, которые находились на стадии доклинических испытаний выращивания и пересаживания клеток, самостоятельно производящих инсулин.

