Выращивание ребенка в пробирке
Выращивание ребенка в пробирке
Годы напряженных исследований
Нормальная беременность длится 9 месяцев или 40 недель или 280 дней. Но, как утверждает один из пионеров экстракорпорального оплодотворения, французский врач Рене Фридман, уже через 22 недели или 160 дней будущие земляне способны развиваться сами, вне тела матери. Чтобы им в этом помочь, сегодня ведутся работы по созданию искусственной плаценты и синтетической околоплодной жидкости.
«После зачатия эмбрион начинает расти в особой оболочке, но уже через 6-7 дней он ее прокалывает и прикрепляется к матке женщины, — говорит Рене Фридман. – Однако он с тем же успехом мог бы развиваться и в другой утробе. Правда, наличие утробы – естественной или искусственной – обязательно: без него не будет развития, не смогут сформироваться органы маленького человечка».
В лаборатории на Манхеттене выращивается 10 тысяч детей «из пробирки» в год. Это целая фабрика людей. В день на свет появляются 27-28 детей. Сотрудники лаборатории считают, что женщина должна планировать свою жизнь. Если она заморозит свою яйцеклетку до определенного возраста, тогда сама сможет решать, когда ей вынашивать и рожать дитя.
Здесь же ведутся и эксперименты по выращиванию живых существ вне материнских утроб. Например, ученые создают искусственную матку, помещают туда эмбрион мыши и смотрят, как он развивается. В 2002 году доктор Лиу уже вырастила подобным образом мышонка. Он родился живым, но калекой. Тогда это событие вызвало широкий общественный резонанс, было много мнений «за» и «против». После этого доктор Лиу, по ее словам, переоценила этическую сторону данных экспериментов. Она поняла, что такие эксперименты и их результаты могут сильно изменить общество. После этого она стала работать только с мышиными эмбрионами, хотя раньше проводила исследования и на эмбрионах человека.
В японском университете Китасато искусственно выращивают козла. За несколько недель до родов его извлекают из матери, вводят в его тело два зонда, погружают его в специальную жидкость. Можно наблюдать, как недоношенный козлик глотает, зевает и икает. Через полчаса он начинает двигаться. Одна из основных задач, по утверждению исследователей, — правильно рассчитать величину потока питательных веществ, поступающих в организм подопытного существа. Если поток большой, происходит кровоизлияние. Если маленький – возникает кислородная недостаточность. Вначале такие козлята жили всего один день. Теперь – 20 дней. Чтобы добиться такого прогресса, докторам Унно и Куробаре потребовалось 9 лет напряженных исследований.
Играть и кувыркаться в раю
Конечно, материнская утроба – рай для младенца. Здесь ему хорошо и уютно, он может играть с пуповиной и кувыркаться, что в дальнейшем благотворно воздействует на его будущую моторику. На развитие плода влияет очень много факторов. Возможно ли их воссоздать в искусственной утробе – пока этот вопрос остается без ответа. Есть опасения, что выращенный таким образом ребенок может страдать слабоумием, аутизмом или эпилепсией.
Авторы фильма приводят любопытную статистику. На сегодняшний день в мире 95 миллионов беременных женщин. Каждую секунду на свет появляется 5 малышей. То есть за то время, что зритель смотрел этот фильм, родилось 15 тысяч детей.
Технически возможно, но не скоро. Да и надо ли?
По итогам просмотра документальной картины отечественные специалисты смогли высказать свою точку зрения по поднятому в ней вопросу. Создание искусственной утробы, о котором говорилось в фильме, если и произойдет, то не скоро, считает Наталья Кан, заведующая акушерским отделением Научного центра акушерства, гинекологии и перинатологии им. В.И.Кулакова. Ведь мать и ребенок – две очень сложных системы, которые существуют в зависимости друг от друга. Между ними происходит не только передача кислорода, гормонов, питательных веществ – это еще и очень сложные иммунологические отношения, нервные взаимодействия. Плод не просто растет внутри матери, он подает ей свои сигналы, говоря о том, что ему нужно, и как эту потребность можно скорректировать. Для того чтобы разгадать этот «язык», потребуется не 15 и не 20 лет, а как минимум 50. Да, выхаживать младенцев с 22 недель можно (с этого возраста, по критериям Всемирной организации здравоохранения, это уже не плод, а ребенок). Но, как выразилась Н.Кан, «качество их жизни не такое, какого бы нам хотелось для своих детей» и вообще «исходы выхаживания младенцев с 22 до 24 недель не очень благоприятные». Процент летальности очень высок – в районе 70%, несмотря на то, что применяется самое современное оборудование и новейшие технологии. Причина такой печальной картины – незрелость нервной системы. Если даже такие дети и выживают, то они, как правило, являются инвалидами по зрению, слуху и т.д.
Младенцы возрастом 24-26 недель имеют гораздо больший шанс на выживание: по словам Виктора Зубкова, заведующего отделением неонаталогии и педиатрии Научного центра акушерства, гинекологии и перинаталогии им. В.И.Кулакова, в живых из них остается до 86%. При этом детишки бывают совсем крошечные – всего по 500 граммов. Встречаются среди них и почти совершенно здоровые, например, с минимальными мозговыми дисфункциями – они менее усидчивы, более подвижны. Однако В.Зубков считает, что таких детей можно относить к абсолютно здоровым. Что касается возможности создания искусственной матки, то технически это возможно – вопрос времени, однако на передний план здесь выступают иные аспекты – моральные, этические, экономические. Насколько это новшество необходимо – сказать трудно.
Ольга Исупова, старший научный сотрудник Института демографии Высшей школы экономики, констатирует факт: репродуктивные желания женщины, вероятно, стали меньше. Во всяком случае, количество бездетных женщин растет (если раньше в нашей стране их было 7%, то теперь – 17-20%), и это связано даже не с бесплодием, а с комплексом причин: современная жизнь не слишком-то способствует тому, чтобы отвлекаться на рождение и воспитание ребенка. В Германии в некоторых поколениях бездетными остаются до 30% женщин. Поэтому, принимая во внимание эти факты, можно сделать вывод, что потребность в искусственной матке у общества есть. Ведь существуют женщины, которые хотят быть матерями, но беременными быть не желают, резюмирует О.Исупова.
Любое научное открытие – это двуликий Янус, обоюдоострый меч, которое имеет и положительную, и отрицательную сторону, полагает Галина Муравник, генетик, преподаватель биоэтики Свято-Филаретовского православно-христианского института. Тревожит, что многие ученые, разрабатывая свои революционные технологии, не задумываются над их этической стороной. Если искусственная матка будет помогать глубоко недоношенным детям или, к примеру, женщинам, которым беременность противопоказана по состоянию здоровья, – это благо. Но если это выродится в то, что некоторые женщины в силу своего крайнего эгоизма будут перекладывать деторождение на искусственную матку, чтобы делать карьеру, зарабатывать деньги, не «выпадать» из бизнеса, заниматься спортом, – это совсем другое. Тогда искусственная матка этот эгоизм будет поддерживать и развивать, и в этом плане она – вещь очень опасная.
Ребенку, находящемуся в утробе матери, ее стресс, скорее всего, идет на пользу, рассуждает Сергей Северин, начальник отделения молекулярной биологии Научно-исследовательского центра «Курчатовский институт», член-корреспондент РАН. Это своего рода тренинг, позволяющий приспособиться к неблагоприятным условиям внешней среды. Создать искусственный вариант такого взаимодействия между матерью и ребенком практического нельзя – слишком уж они сложны. По всей видимости, продвижение в этой сфере возможно не ранее, чем через 40-50 лет.
К такой же цифре склоняется и биофизик, футуролог Игорь Артюхов. Однако на пути к успешной реализации данной технологии надо ответить на ряд вопросов: как общество будет воспринимать эту технологию; как оно будет относиться к ребенку, появившемуся на свет в результате ее применения; как этот ребенок будет сам себя воспринимать?
Вопросов еще слишком много. Ответов пока мало. Человечество задумалось…
Бог из пробирки
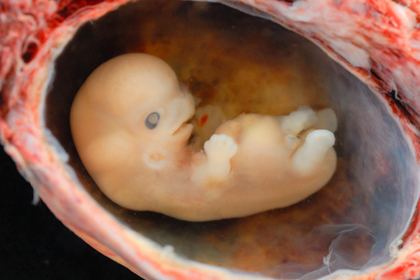
Биологам впервые удалось вырастить в пробирке эмбрионы, достигшие стадии внедрения в стенку матки. До этого исследователи получали зародышевые тельца, которые не развивались дальше этого этапа. Теперь специалисты могут создавать удобные платформы для изучения развития животных и человека, а также решить проблемы разработки искусственной утробы. «Лента.ру» рассказывает о научной работе ученых из Кембриджского университета, опубликованной в журнале Science.
Развитие позвоночных животных от одной клетки до многоклеточного организма — процесс очень сложный. В нем несколько стадий, в результате которых формируются различные группы влияющих друг на друга клеток. Хотя во всех одна и та же ДНК, от их местоположения в зародыше зависит то, какие гены будут активными. Это, в свою очередь, определяет функции клеток в тканях формирующегося организма.
Материалы по теме

Геноцид во благо
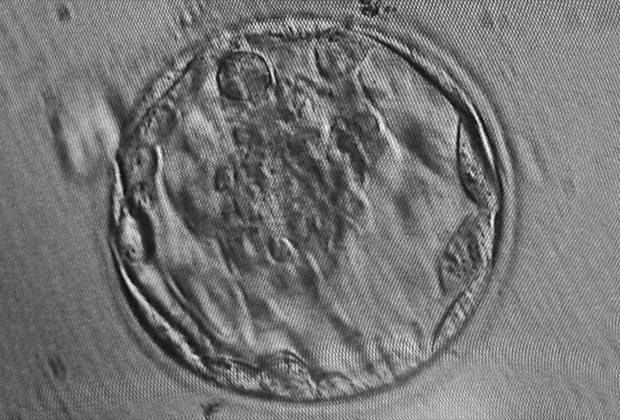
У млекопитающих развитие эмбриона может происходить как в теле матери, так и в яйце (у ехидны и утконоса). Зародыш возникает при оплодотворении ооцита (яйцеклетки). После этого происходит ее дробление — ряд делений с образованием все более мелких клеток (бластомеров). В результате формируется морула — шар, все внутреннее пространство которого заполнено 16-ю бластомерами.
За стадией морулы следует стадия бластоцисты. Бластомеры продолжают делиться, все более уплотняясь и образуя полую сферу. В ней запускается процесс дифференцировки клеток, и образуются два типа клеток: трофобласт, формирующий внешний слой бластоцисты, и эмбриобласт (внутренняя клеточная масса), находящийся внутри нее. Эмбриобласт создает компактное образование у одного из полюсов бластоцисты.
На стадии бластоцисты в клетках зародыша происходят процессы, которые устанавливают оси симметрии, а также регулируют экспрессию генов, что на следующих этапах приведет к формированию различных тканей. Эмбрион, который ранее напоминал сферу, становится асимметричным. Трофобласт дает начало экстраэмбриональным (внезародышевым) тканям, из которых затем образуются плацента, желточный мешок и амнион. Из эмбриобласта развиваются еще две группы клеток — эпибласт и гипобласт.
Из эпибласта в итоге формируется тело будущего организма. Однако это происходит только при том условии, что клетки данной группы взаимодействуют с внезародышевыми тканями. Гипобласт способствует образованию некоторых внезародышевых структур, в том числе примитивной энтодермы, которая дает потом висцеральную энтодерму, окружающую эпибласт и выполняющую регуляторные функции.
После того как бластоциста внедряется в слизистую матки в процессе беременности, структура зародыша меняется, постепенно усложняясь. Клетки эпибласта упорядочиваются, образуя форму розетки. Внутри возникает полость. Трофобласт в это время превращается во внезародышевую эктодерму (ExEc), в которой также есть полость. В конце концов обе полости соединяются. Кроме того, возникают мезодерма и первичные половые клетки, образуется зародышевый цилиндр.
Эпибласт состоит из эмбриональных стволовых клеток (ЭСК), способных дифференцироваться в три зародышевых листка: эктодерму, мезодерму и энтодерму. Клетки этих трех слоев — плюрипотентные, то есть могут превратиться во все типы клеток взрослого организма. Именно поэтому ЭСК используются для создания зародышеподобных структур — эмбриоидов. Они помогают понять механизмы развития плода, однако проблема в том, что в них не воспроизводятся процессы, протекающие in vivo (в живом организме) после внедрения в стенку матки.
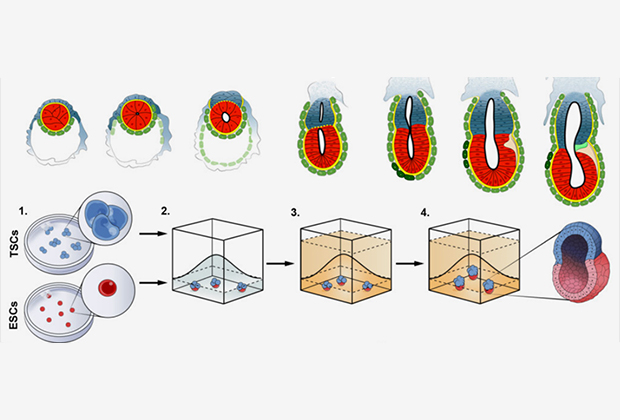
Ученые решили убедиться в том, что внезародышевые ткани обеспечивают дальнейшее развитие эмбриона, проведя соответствующие эксперименты in vitro (в пробирке). Взяли эмбриональные стволовые клетки и небольшие группы стволовых клеток из трофобласта (ТСК) — предшественников клеток внезародышевых органов. Из них были получены клеточные культуры, имитирующие взаимодействие эпибласта с трофобластом. Связи между клетками осуществлялись через трехмерные внеклеточные структуры из коллагенового матрикса «Матригель».
Матрикс заменял в культуре примитивную энтодерму, обеспечивая поляризацию клеток эпибласта и формирование полости. Оказалось, что в этих условиях ЭСК и ТСК образовывали форму, напоминающую зародышевый цилиндр и характерную для эмбрионов мышей после имплантации. Однако была не только внешняя схожесть. Тщательный анализ морфологии, размера, числа клеток и активности генов, характерных для определенных клеточных линий, показал, что в эмбрионах как in vivo, так и in vitro присутствовали отдельные структуры, полученные из стволовых клеток эпибласта и трофобласта.
Исследователи выделили несколько этапов развития зародыша в пробирке. Сначала наблюдается спонтанная самоорганизация, которая приводит к поляризации клеток и образованию полостей внутри эмбриональной и экстраэмбриональной частей зародыша. Затем полости объединяются в один большой эквивалент проамниотической полости. Потом две группы стволовых клеток взаимодействуют через сигнальный путь Nodal. Сигналами служат белки, участвующие в эмбриональной индукции; они направляют развитие отдельных частей зародыша — например, способствуют формированию нервной системы. Все завершается выделением костного морфогенетического белка, который индуцирует образование клеток, напоминающих первичные половые клетки.
Результаты исследования важны для решения проблемы создания искусственной утробы. В этом устройстве можно было бы вынашивать зародыши без участия живого существа. Однако до сих пор известны не все факторы, влияющие со стороны организма матери на дифференцировку клеток. Например, пока совершенно непонятна роль имплантации бластоцисты. Культивирование плодов in vitro в постимплантационный период невозможно без изучения того, что происходит с клетками зародышей в этот период. Новые эмбриоиды позволят проводить соответствующие исследования.
«ЭКО-поколение» в России: как детей выращивают в пробирках

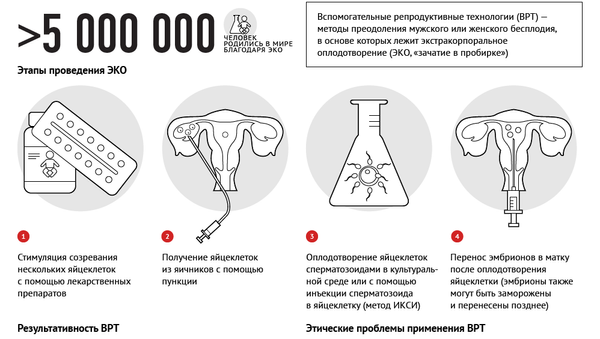
МОСКВА, 20 дек — РИА Новости. Ежегодно в научном Центре акушерства и гинекологии имени Кулакова врачи проводят около 2 тысяч циклов экстракорпорального оплодотворения (ЭКО), рассказала РИА Новости руководитель отделения вспомогательных репродуктивных технологий в лечении бесплодия Елена Калинина.
Корреспонденты РИА Новости побывали в лаборатории Центра, в котором в 1986 году появился на свет первый в России ребенок из поколения ЭКО, и где с тех пор детей бережно выращивают в пробирках, как цветы.
Экстракорпоральное оплодотворение (ЭКО) — «искусственное оплодотворение», вспомогательная репродуктивная технология, используемая в случае бесплодия.
В термостате тепло и уютно
Перед закрытой стеклянной дверью в небольшом коридорчике, скрестив пальцы за спиной, сидят три женщины в стерильных халатах и шапочках и взволнованно ждут, когда их вызовет врач. Скоро каждая из них станет участницей медицинского таинства — современного непорочного зачатия. И они втроем мысленно обращаются к небесам, чтобы там услышали молитвы и подарили счастье — стать мамой.

Новая жизнь во время ЭКО зарождается не в утробе матери, а в специальной чашке под микроскопом. За слиянием яйцеклетки и сперматозоида, как за остросюжетным фильмом, опытные врачи следят по монитору компьютера.
Сразу после оплодотворения человеческие эмбрионы помещают в термостат. Внутри — идеальная питательная среда для развития будущего малыша: сахара, аминокислоты, антибиотики. И идеальная температура — такая же, как в организме только что забеременевшей женщины: 37 градусов. Каждый термостат рассчитан на четыре пациентки, однако перепутать эмбрионы невозможно, утверждает врач Калинина. Все они хранятся в индивидуальной ячейке, на крышке которой указана фамилия женщины и дата оплодотворения.
Почти пять дней мама находится только в субъективном психическом контакте с будущим ребенком, которого на исходе пятых суток иногда можно увидеть невооруженным глазом, как крохотную, меньше, чем полмиллиметра, точку. Точнее ее размер исчисляется приставкой «нано». И только через трое-пятеро суток после оплодотворения с помощью врачей начинается физическое сближение, и малыш, наконец, воссоединяется с мамой. Шансы на успешную беременность повышаются, если женщине подсаживают сразу два эмбриона. Именно поэтому в 20% случаев после ЭКО рождаются двойни.
Оставшиеся и неиспользованные после оплодотворения эмбрионы отдают в заботливые руки хранительницы криобанка, которая заморозит их и будет «нянчить», пока семейная пара не решится родить братика или сестричку своему первенцу.
«ЭКО — достаточно дорогостоящая процедура и связана с повышенной гормональной нагрузкой на женщину. Чтобы не прибегать к ЭКО в следующий раз, родители могут заморозить полученные эмбрионы и использовать их, например, через два года или через пять лет», — пояснила Калинина.
Замороженное счастье
«В природе все удивительно, ведь если заморозить эмбрионы или сперму в обычном холодильнике при температуре минус 18 градусов, они погибнут, а экстремально низкие температуры позволяют десятилетиями сохранять клетки живыми», — рассказала кандидат биологических наук, научный сотрудник отделения ЭКО Виктория Замятнина.
В криобанке хранится сперма примерно тысячи разных мужчин, причем некоторые образцы заморожены еще в 1998 году. Обычно мужчины оставляют свой биоматериал по трем причинам: желание стать донором, необходимость заранее сдать сперму для ЭКО или перед химиотерапией, результатом которой может стать необратимое бесплодие.
Не все зависит от врачей
Замораживать яйцеклетки в России начали не более пяти лет назад. В отличие от сперматозоидов, женские половые клетки — более нежная структура, и сохранить их жизнеспособность гораздо сложнее. Поэтому создание банка яйцеклеток в центре Кулакова только планируется.
«По закону женщина может воспользоваться донорской яйцеклеткой, но мы не имеем права говорить, чья это яйцеклетка», — сказал РИА Новости главный врач центра имени Кулакова Виктор Тютюнник.
Если генетическая мать по медицинским показаниям не в силах выносить своего ребенка, взрастить этого малыша в утробе ей может помочь биологическая мама. Практика привлечения суррогатных мам началась в центре около 10 лет назад. «За последние пять лет у нас было чуть больше 100 случаев суррогатного материнства. В 2009-2010 годах около 35 суррогатных матерей вступали в программу, но в этом году только девять», — заметил Тютюнник.

Как правило, для криоконсервации у одной женщины берут около пяти яйцеклеток, но из этих пяти яйцеклеток только одна может быть способна к оплодотворению после размораживания. «Так что не все зависит от врачей, если хотите, на все воля Божья. И даже заморозив однажды свои яйцеклетки, женщина не может быть до конца уверена, что сможет их успешно оплодотворить через несколько лет», — заметила Замятнина.
Судьба эмбриона
Работать с замороженными эмбрионами, каждый из которых через несколько лет имеет шанс превратиться в ребенка, нужно только с любовью и крайне осторожно. Если сперму можно доставать из дюара на несколько секунд, то эмбрионы такого обращения не перенесут и погибнут. Поэтому все манипуляции с биоматериалом проводятся только в жидком азоте. У криохранительницы непременно должны быть ловкие руки, при необходимости она за полсекунды может перенести эмбрионы из дюара в ванночку с жидким азотом для дальнейших манипуляций.
Однако не все эмбрионы «родятся» в будущем. Время проходит, родители стареют и уже не хотят вынашивать своих будущих детей, полученных и замороженных во время ЭКО. По словам Замятниной, редко, но все же случается, что эмбрионы приходится уничтожать. Это одна из причин, почему религиозные организации не приемлют такого способа лечения бесплодия как экстракорпоральное оплодотворение. Гуманно ли убивать ненужные генетическим родителям живые человеческие эмбрионы и кто несет ответственность за это решение?
«Можно я не буду отвечать? Это очень моральный вопрос», — сказала Замятнина.
Через 30 лет людей начнут массово выращивать вне тела
По мнению некоторых футуристов, вынашивание ребенка в искусственной матке вне человеческого тела получит широкое распространение уже через 30 лет. Сторонники эктогенеза, отвергающие естественный отбор, уже проводят эксперименты по выращиванию эмбрионов животных в утробе, прикрепленной к искусственной плаценте.

Сторонники эктогенеза считают, технология позволит уменьшить количество смертей при родах, поскольку плод будет находиться под постоянным контролем. Противники направления опасаются, что неестественный способ рождения ребенка приведет к переосмыслению социальных ролей, а отсутствие контакта с матерью отрицательно скажется на развитии ребенка.
Эктогенез предполагает бестелесное выращивание организма. Технологию применяют к животным и бактериям. Для создания искусственной утробы нужна искусственная матка, которая обеспечит плод питанием, и амниотическая жидкость для удаления отходов из развивающегося организма. Всё это подключается к компьютеру, который полностью контролирует развитие плода.

Альтернативный метод воспроизводства может подойти женщинам, имеющим проблемы с зачатием и вынашиванием ребенка. Эктогенез также позволит отказаться от суррогатного материнства и обзавестись детьми в любом возрасте.
С другой стороны, женщинам, решившим сделать аборт, будет предложено поместить эмбрион в искусственную матку для последующего выращивания. После рождения этот ребенок может быть передан в приемную семью. С развитием эктогенеза также изменится представление о традиционной семье — одиноких родителей станет больше.
Американо-венгерский футуролог Золтан Иcтван рассказал в интервью интернет-изданию Motherboard, что использование технологий эктогенеза станет возможным в течение ближайших 20 лет. А уже через 30 лет, по его мнению, бестелесное выращивание людей будет поставлено на поток. Иcтван отмечает, что большая часть необходимых для этого технологий уже существует, процесс затягивают юридические вопросы и проблемы нравственного и этического характера. Ну а там подоспеет и искусственный интеллект.
Новая технология оплодотворения позволит выбирать внешность ребенка


«Дизайн младенцев» является своего рода гипотетической головоломкой, которая сводит ученых с ума. Предположим, вы хотите выбрать внешность вашего ребенка так же, как сейчас можете настроить интерьер гостиной или внешний вид автомобиля. Разумеется, без вмешательства генетиков и биохимиков здесь не обойтись. Технология экстракорпорального оплодотворения (ЭКО) позволяет родителям в некоторой степени выбрать черты будущего ребенка из огромного списка, которые составляют кураторы банка спермы, но как далеко могут зайти подобные эксперименты?
Группа ученых и биоэтиков упорно работает в направлении, которое в будущем позволит вам программировать внешность ваших детей. Гаметогенез in vitro (IVG) — метод, который позволяет программировать определенные наборы генов в яйцеклетке и сперматозоиде. На практике это означает, что на основе любого генетического материала (даже чешуек кожи) может быть выращен половой агент, который может быть использован для искусственного оплодотворения. Хотите ребенка от знаменитости? Просто украдите салфетку, которой он вытирал губы в ресторане, и принесите ее в клинику!
«Что заключает в себе IVG? Это буквально способность редактировать систему CRISPR. Эта перспективная разработка еще только развивается, но уже сейчас ее потенциал позволяет предсказать будущее, в котором генетическая корректировка уже не будет чем-то сверхъестественным», говорит Гленн Коэн, профессор из Гарвардского университета и один из авторов новой стать и в журнале Science Translational Medicine. Он предупреждает, что IVG может быть источником множества политических и этических дилемм, и в это легко поверить.
IVG позволяет легко производить огромное количество эмбрионов, а технологии манипулирования CRISPR позволят легко отредактировать те или иные генетические параметры, выбрав в итоге наиболее привлекательные для имплантации варианты. Коэн сравнивает это с тем, как роспись Микелянджело Сикстинской капеллы отличается от повседневного труда современного дизайнера в Photoshop. «Если естественный процесс эмбрионального развития идет долго и по заранее определенному сценарию, со всеми вытекающими из этого минусами, то здесь мастер может перепробовать тысячу вариантов перед тем, как наконец найдет максимально подходящую ему комбинацию», говорит он.
В действительности, до подобных масштабов еще очень далеко. В настоящее время IVG протестирован только на мышах, а технология изменения CRISPR, столь часто фигурирующая как основной аргумент прорыва в генетике, на самом деле исследована лишь незначительно. В качестве тормозящих факторов выступают как несовершенные технологии, так и огромное количество экономических, этических, политических, религиозных и иных социальных аспектов, которые иногда попросту перекрывают ученым кислород. Чтобы такая деликатная отрасль, как эмбриональная генетика, развивалась в полную силу, нужно передовое оборудование, миллионы долларов инвестиций и отсутствие каких бы то ни было ограничений, чего в современном мире добиться практически невозможно.
Существуют определенные сложности и с технической стороны вопроса. Сейчас, если вы хотите отредактировать генетическую структуру эмбриона, вам придется сначала осуществить взаимодействие сперматозоидов с яйцеклетками, а после надеяться, что у вас получится эмбрион с необходимым вам набором базовых признаков, к тому же без каких-бы то ни было посторонних и патологических особенностей. Но если вы работаете со стволовыми клетками, их можно отредактировать еще до того, как они превратятся в половые, а стало быть у вас есть почти бесконечное число попыток.
По мнению Коэна, IVG не может рассматриваться в качестве полноценной репродуктивной технологии. Вместо этого, ученый предлагает разработать определенный набор правил, основанный на этической и научной оценках процесса. В будущем технология может легко выйти из-под контроля общества, хотя и стоит отметить, что она позволит практически полностью решить проблемы с бесплодием по всему миру. Но это будет еще не скоро.
Ученые раскрыли тайны раннего развития человека


Ученые хорошо изучили самые ранние этапы жизни многих животных, тогда как развитие человека во многом остается загадкой.

— Нас немного смущает, что в начале двадцать первого века мы знаем больше о рыбах, мышах и лягушках, чем о самих себе, — отметил биолог из университета Рокфеллера Али Бриванлоу. — Это не просто объяснить своим студентам.
Сейчас белых пятен на этом научном поле стало чуть меньше. В рамках последнего исследования ученые наблюдали, как клетки в эмбрионах начали дифференцировать и выявили особенности, которые являются уникальными для человеческого развития. Например, Бриванлоу и его коллеги выявили группу клеток, которая появляется в эмбрионе в районе 10-го дня, а затем внезапно исчезает на 12-й. Биологи пока не выяснили функцию этого кластера клеток, который на пике развития составляет 5-10 процентов зародыша. Похоже, это некий переходный орган, сродни хвосту, который начинает расти у эмбрионов позже, но затем пропадает еще до рождения. «Это как открытие нового органа в вашем теле», — говорит Али Бриванлоу.
Индустрия рождаемости также может извлечь выгоду из новой технологии выращивания эмбрионов. Норберт Глейхер, руководитель Центра репродукции человека в нью-йоркской клинике искусственного оплодотворения, отмечает, что около 50 процентов эмбрионов, которые имплантируют в матку матери, не выживают. Последние исследования могут помочь ученым понять, что идет не так в подобных случаях.

— Процесс имплантации — это большой черный ящик для нас, — говорит Глейхер, который ранее уже сотрудничал с Али Бриванлоу. Сейчас медик планирует использовать наработки своего коллеги, чтобы лучше оценивать жизнеспособность эмбрионов перед их имплантацией в клиниках.
Способность вырастить эмбриона в пробирке до 13-го дня жизни поднимает ряд этических и политических проблем. В 12 странах мира, в том числе США и Великобритании, ученым запрещено работать с эмбрионами старше 14 дней. Это крайний срок, когда эмбрион можно разделить на идентичных близнецов, затем, как подсказывает логика, начинает формироваться уникальный индивидуум.
Ученые сомневаются, что их эмбрионы прожили бы сильно дольше, чем 14 дней. Дело в том, что на более позднем сроке организм нуждается в смеси гормонов и питательных веществ от матери, точный состав которой до сих пор не известен. Чтобы узнать больше, исследователи уже начали эксперименты с эмбрионами приматов и коров.
Ребенок «из пробирки «
Сейчас никого не удивишь словами «дети из пробирки» или «искусственное оплодотворение». Каковы же возможности вспомогательных репродуктивных технологий? И в каких случаях ими можно воспользоваться?
Кому поможет ЭКО?
В июле 2008 г. исполнилось 30 лет Луизе Браун — первому ребенку, зачатому искусственным путем с помощью так называемого экстракорпорального оплодотворения (ЭКО). Тогда эта сенсация произвела эффект разорвавшейся бомбы. Сегодня отрасль медицины, занимающаяся вспомогательной репродукцией, развивается семимильными шагами, давая возможность испытать счастье материнства тысячам женщин, которым еще пару десятилетий назад медицина бессильна была помочь.
В основе бесплодия лежит невозможность слияния сперматозоида с яйцеклеткой, которая может быть связана с нарушениями как в женском, так и в мужском организмах: либо снижено качество спермы, либо нарушена функция одного из органов женской репродуктивной системы.
Метод ЭКО был разработан для женщин с так называемым «трубным» фактором бесплодия, при котором маточные трубы либо непроходимы, либо отсутствуют вовсе. Принцип метода прост: заменить функцию поврежденных маточных труб процессом, проходящим в лабораторных условиях, максимально приближенным по всем показателям к естественному. Иными словами, «встреча» сперматозоидов и яйцеклетки происходит не в организме женщины, а в «пробирке», с последующим переносом эмбрионов в матку матери.
На сегодняшний день проведение ЭКО практикуется при любой форме бесплодия, когда наступление беременности с помощью вспомогательной репродукции вероятнее всего, Иными словами, при безуспешном лечении различных форм бесплодия в течение 1,5-2 лет рекомендовано ЭКО как наиболее эффективный способ достижения беременности (в среднем 30-40% с первой попытки).
Ход программы ЭКО
Подготовка к проведению программы ЭКО занимает в среднем 1-2 месяца. Подготовка включает, как правило, инфекционное и гормональное обследование, в ряде случаев — консультации эндокринолога, маммолога, андролога и других специалистов, если это необходимо. Вся программа проводится амбулаторно, качество жизни женщины при этом не страдает, Анализы и обследования для каждой пары определяются по результатам приема.
Проведение программы состоит из нескольких этапов:
- Этап первый — стимуляция овуляции, которая проводится с помощью специальных препаратов под контролем УЗИ. С помощью УЗИ врач-репродуктолог отслеживает рост и созревание фолликулов в яичниках, определяет дозировки препаратов и длительность стимуляции. Чаще всего она начинается на 2-3-й дни менструального цикла женщины и продолжается 9-11 дней. Женщине 1 раз в сутки делают инъекцию препарата, стимулирующего рост фолликулов, пациентка не испытывает при этом никаких субъективных ощущений.
- Этап второй — пункция фолликулов трансвагинальным доступом (через стенку влагалища), которая проводится под контролем УЗИ с использованием кратковременного внутривенного обезболивания. Женщине делают внутривенный укол, она засыпает, у нее забирают несколько яйцеклеток, созревших после стимуляции. Все полученные яйцеклетки оплодотворяются спермой мужа (либо донора, в зависимости от клинической ситуации). Сперму подготавливают специальным образом, отбирая для оплодотворения самые здоровые сперматозоиды, которые осторожно помещаются в специальные чашки с яйцеклетками). При этом, если причиной бесплодия стал мужской фактор, при котором естественное проникновение сперматозоидов в яйцеклетку невозможно, проводится процедура ИКСИ — интрацитоплазматическая инъекция сперматозоида в яйцеклетку, когда сперматозоид помещается в цитоплазму яйцеклетки вручную — с помощью специального устройства, похожего на шприц (специальный микроманипулятор), под электронным микроскопом. Важно отметить, что это лишь способ попадания сперматозоида в яйцеклетку, не влияющий на процесс оплодотворения.
- Этап третий — эмбриологический, он продолжается 2-5 дней. Отслеживается развитие эмбрионов, их количество и качество, определяется оптимальный день для переноса эмбрионов в полость матки. Каждый день эмбриолог исследует эмбрионы под микроскопом, оценивая, правильно ли они делятся, нет ли задержки в развитии, нет ли фрагментации — включений, которых в норме не должно быть.
- Этап четвертый — перенос эмбрионов. Это безболезненная процедура, которая проводится под контролем УЗИ с помощью специального катетера для переноса эмбрионов. Проводится чаще всего на 3-й или 5-е сутки развития эмбринов.
Экскурс в физиологию
Сейчас во всем мире принято переносить не более 2 эмбрионов в полость матки во избежание многоплодной беременности. В исключительных случаях могут быть перенесены 3 эмбриона — например, при нескольких неэффективных программах ЭКО в прошлом, после перенесенных операций на матке, женщинам старше 40 лет, когда шансы на успешную имплантацию эмбрионов в слизистую матки значительно снижены.
После переноса эмбрионов репродуктолог назначает женщине специальные препараты для поддержки потенциальной беременности на 12-14 дней, пока не будет известен результат проведенной программы. Через 2 недели после переноса эмбрионов женщина сдает анализ крови на беременность, при положительном результате еще через неделю проводится УЗИ, чтобы определить наличие одного или двух (иногда трех) плодных яиц в полости матки. Двойни при этом констатируются в 10-15% случаев, тройни — в 3-7%. Многоплодная беременность является своеобразным «осложнением» программ ЭКО, репродуктологи всего мира озадачены поисками возможных путей решения этой проблемы. Некоторые клиники ЭКО в Европе и Америке перешли на перенос 1 эмбриона на стадии бластоцисты, то есть 5-дневного эмбриона (селективный перенос) и, несмотря на то, что частота наступления беременности несколько снизилась, считают эту меру действенной, поскольку резко снизилось количество осложнений, связанных с вынашиванием многоплодной беременности и последующими родами.
Развитие технологии ЭКО
Донорство в ЭКО
Важной вехой в развитии вспомогательной репродукции стало создание банка половых клеток — сперматозоидов и ооцитов (яйцеклеток). И если к словосочетанию «банк спермы» мы уже давно привыкли, то «банк донорских ооцитов» — понятие для большинства россиян относительно новое, и очень немногие клиники имеют собственный банк донорских ооцитов.
В наше время спрос на донорские ооциты значительно превышает предложение. Возможно, это связано с тем, что женщина в первую очередь стремится реализовать себя в учебе, затем в карьере и только потом задумывается о деторождении. И все чаще это происходит ближе к сорока годам, когда яичники работают значительно хуже или не работают совсем, и собственные ооциты использовать уже невозможно. В таких ситуациях единственный выход — использовать донорские яйцеклетки. В случае, когда женщине по каким-либо медицинским показаниям удаляют яичники (причем иногда — в молодом возрасте), на помощь также приходят донорские яйцеклетки. Донорами яйцеклеток являются женщины до 30 лет, имеющие хотя бы одного здорового ребенка старше 1 года. Клиника проводит каждой из них полное клиническое, генетическое и ультразвуковое обследование, их в обязательном порядке консультирует психиатр. По результатам обследования принимается решение о возможности использования данной женщины в качестве донора ооцитов, и ее данные (возраст, рост, вес, цвет глаз, группа крови и т. п.) размещаются в базе данных клиники под специальным кодовым номером, так как донорство половых клеток является анонимным. Иногда в качестве донора яйцеклеток выступает родственница или знакомая реципиентки, если она подходит по всем установленным стандартам.
Иногда эякулят мужчины совершенно не содержит сперматозоидов или использовать сперматозоиды невозможно в силу генетических нарушений, несовместимых с рождением нормального потомства. К сожалению, лекарств, способных помочь в подобных случаях, пока не существует, и выходом может быть использование донорской спермы.
Мужское бесплодие
Обследование эмбрионов
Наивысшим достижением последних лет, безусловно, можно считать появление возможности генетического обследования будущего ребенка еще до его переноса в матку. Для этого проводится так называемая предымплантационная генетическая диагностика (ПГД). Однако она невозможна без проведения ЭКО, поскольку исследование проводится на 3-дневных эмбрионах, которые в естественных условиях просто недоступны.
С помощью биопсии одного бластомера (отщипывается одна из «клеток», из которых состоит эмбрион, и подвергается генетическому исследованию) исследуется хромосомный набор каждого эмбриона и при необходимости определяется его пол (при вероятности наследственного заболевания, сцепленного с полом, например гемофилии, когда рождение мальчиков нежелательно, потому что проявляется болезнь именно у мужчин). Затем 1-2 здоровых эмбриона нужного пола (в случае с гемофилией — это девочки) без хромосомных нарушений на 5-е сутки развития переносятся в полость матки. Это дает шанс людям с наследственными хромосомными заболеваниями иметь здоровых детей, что было совершенно невозможно еще несколько лет назад, В настоящее время есть возможность диагностировать с помощью ПГД нарушения в 5 хромосомах, самое известное из них — синдром Дауна (трисомия по 21-й хромосоме). Остальные хромосомы пока недоступны для исследования, однако в этом направлении ведутся постоянные разработки, и хочется верить, что в ближайшем будущем медицина будет располагать всем необходимым для полноценного генетического обследования.
Еще одним минусом ПГД является ее высокая стоимость, сравнимая на сегодняшний день со стоимостью ЭКО.
Финансирование ЭКО
С 2006 г. в России начала работать программа федерального финансирования высоких технологий, в том числе и ЭКО, в связи с этим у гораздо большего числа бесплодных пар появится возможность провести ЭКО бесплатно. Сначала пара обращается к участковому гинекологу, получает список необходимых документов, собрав которые проходит собеседование в Минздравсоцразвития, где специальная комиссия выносит решение о возможности проведения бесплатного ЭКО. Если принимается такое решение, то пару направляют в конкретную клинику, которая проводит данные программы.
Несколько клиник репродукции в России получили возможность проводить бесплатные программы ЭКО. Согласно приказу Минздравсоцразвития Московской области от 29.08.2007 г., услуга предоставляется парам, состоящим между собой в зарегистрированном браке и не имеющим общих детей по причине женского бесплодия, при условии, что женщине не более 38 лет. В рамках этой программы Правительство Московской области финансирует жителям региона проведение 2 попыток ЭКО. При положительном решении пара проходит обследование по месту жительства и направляется в рекомендованную клинику ЭКО.
Светлана Гошовская,
врач гинеколог-репродуктолог, г. Москва
