Выращивание искусственных тканей
Ученые нашли способ выращивания искусственной сетчатки глаза
Уже на сегодняшнем уровне развития медицины мы можем выращивать множество тканей для трансплантации. Но проблема в том, что относится это по большей части лишь к довольно «просто» устроенным тканям вроде кожи, костей или мышц. И чем более сложное устройство имеет ткань — тем сложнее ее создать «в пробирке». На первом месте по сложности выращивания стоит, пожалуй, нервная ткань головного, спинного мозга и сетчатки. И именно способ создать последнюю недавно нашли эксперты из Университета Джонса Хопкинса (США).

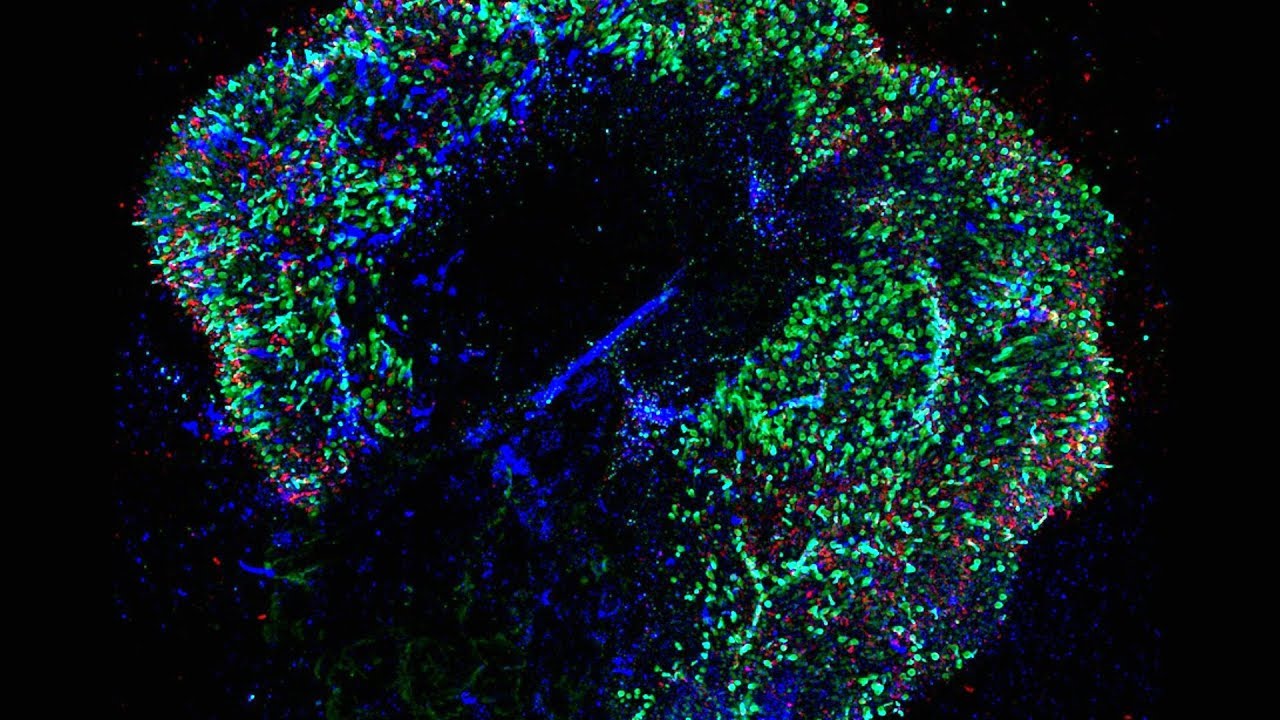
Основной проблемой при создании любых типов тканей в лабораторных условиях является выяснение триггерных факторов и условий, приводящих к дифференцировке клеток-предшественников. Ведь получить стволовые клетки не составляет особой проблемы. Клетки сетчатки, как известно, делятся на 2 типа, отвечающие за дневное и сумеречное зрение — палочки и колбочки. Причем, клетки, которые распознают цвета, делятся еще на 3 подвида: клетки S-типа улавливают сине-фиолетовую часть спектра, клетки М-типа — зелено-желтую, а клетки L-типа — красную (к слову, именно дефект в тех или иных клетках отвечает за развитие различных форм дальтонизма). И все эти клетки развиваются из одной популяции. И ученые обнаружили, что именно влияет на их развитие.
В ходе исследований позвоночных животных и человека было выявлено, что важнейшую роль на процессы формирования клеток сетчатки играют тиреоидные гормоны щитовидной железы и в частности трийодтиронин. Добавление трийодтиронина в питательную среду со столовыми клетками при определенных условиях запускает процесс специализации клеток. Причем, избыток гормона вызывает блокирование созревания клеток S-типа и развитие M и L-клеток, а недостаток трийодтиронина, напротив, провоцирует угнетение развития M и L клеток формирование клеток по S-типу.

Развитие различных клеточных линий в зависимости от уровня концентрации гормона щитовидной железы
Процесс этот довольно трудоемкий, но исследователи смогли вырастить функционирующий органоид сетчатки, реагирующий на свет и даже выпустили короткий демонстрационны ролик, доступный ниже. По признанию авторов, их изыскание может стать не только ключом к созданию искусственной сетчатки, но и к терапии дальтонизма и других нарушений зрительных функций.
Эту и другие новости вы можете обсудить в нашем чате в Телеграм.
Искусственные органы: человек умеет все


Основания для оптимизма, конечно же, есть. В наши дни в науке наметилось несколько направлений, которые, возможно, позволят в близком или дальнем будущем превратить Homo sapiens в более долговечную и надежную мыслящую конструкцию. Первое — это создание электронно-механических «подпорок» для недужного тела. Речь идет о роботизированных бионических протезах конечностей, достоверно воспроизводящих человеческую локомоторику, или даже целых экзоскелетах, которые смогут подарить радость движения парализованным.
 Мозг Выращивание нервной ткани — наиболее сложно из-за многообразия типов составляющих ее клеток и их сложной пространственной организации. Однако на сегодня существует успешный опыт выращивания аденогипофиза мыши из скопления стволовых клеток.
Мозг Выращивание нервной ткани — наиболее сложно из-за многообразия типов составляющих ее клеток и их сложной пространственной организации. Однако на сегодня существует успешный опыт выращивания аденогипофиза мыши из скопления стволовых клеток.
Эти хитроумные изделия дополнит нейромашинный интерфейс, который позволит считывать команды прямо с соответствующих участков головного мозга. Действующие прототипы подобных устройств уже созданы, теперь главное — их совершенствование и постепенное удешевление.
Вторым направлением можно считать исследования генетических и прочих микробиологических процессов, вызывающих старение. Познание этих процессов, возможно, в будущем даст возможность затормозить увядание организма и продлить активную жизнь за вековой предел, а возможно, и далее.
 Глаз Поиски ведутся в нескольких направлениях. Одно из них — бионический глаз: электронная камера плюс чип, имплантированный в сетчатку. Есть и некоторые успехи в выращивании сетчатки (пока у мышей).
Глаз Поиски ведутся в нескольких направлениях. Одно из них — бионический глаз: электронная камера плюс чип, имплантированный в сетчатку. Есть и некоторые успехи в выращивании сетчатки (пока у мышей).
И наконец, к третьему направлению относятся исследования в области создания подлинных запчастей к человеческому телу — тканей и органов, которые структурно и функционально будут мало чем отличаться от природных и позволят своевременно «отремонтировать» организм, пораженный тяжелой болезнью или возрастными изменениями. Известия о новых шагах в этой области приходят сегодня едва ли не ежедневно.
Запускаем печать
Базовая технология выращивания органов, или тканевой инженерии, заключается в использовании эмбриональных стволовых клеток для получения специализированных клеток той или иной ткани, например гепатоцитов — клеток паренхимы (внутренней среды) печени. Эти клетки затем помещаются внутрь структуры соединительной межклеточной ткани, состоящей преимущественно из белка коллагена.
 Сердце Наряду с созданием электронно-механических протезов ведется поиск более естественного имплантата, объединяющего в себе выращенные ткани сердечной мускулатуры с наноэлектронной системой контроля.
Сердце Наряду с созданием электронно-механических протезов ведется поиск более естественного имплантата, объединяющего в себе выращенные ткани сердечной мускулатуры с наноэлектронной системой контроля.
Таким образом обеспечивается заполнение клетками всего объема выращиваемого органа. Матрицу из коллагена можно получить путем очистки от клеток донорской биологической ткани или, что гораздо проще и удобнее, создать ее искусственным путем из биоразрушаемых полимеров или специальной керамики, если речь идет о кости. В матрицу помимо клеток вводятся питательные вещества и факторы роста, после чего клетки формируют единый орган или некую «заплатку», призванную заместить собой пораженную часть.
Правда, выращивание искусственной печени, легкого и других жизненно важных органов для пересадки человеку сегодня пока недостижимо, в более простых случаях такая методика успешно применяется. Известен случай пересадки пациентке выращенной трахеи, осуществленной в РНЦ хирургии им. Б.В. Петровского под руководством итальянского профессора П. Маккиарини. В данном случае в качестве основы была взята донорская трахея, которую тщательно очистили от клеток. На их место были введены стволовые клетки, взятые из костного мозга самой пациентки. Туда же были помещены факторы роста и фрагменты слизистой оболочки — их также позаимствовали из поврежденной трахеи женщины, которую предстояло спасти.
 Легкие Проведены успешные эксперименты по имплантации крысе легкого, выращенного на очищенной от клеток донорской матрице.
Легкие Проведены успешные эксперименты по имплантации крысе легкого, выращенного на очищенной от клеток донорской матрице.
Недифференцированные клетки в таких условиях дали начало клетками дыхательного эпителия. Выращенный орган имплантировали пациентке, причем были приняты специальные меры для проращивания имплантата кровеносными сосудами и восстановления кровообращения.
Впрочем, уже существует метод выращивания тканей без применения матриц искусственного или биологического происхождения. Метод нашел воплощение в устройстве, известном как биопринтер. В наши дни биопринтеры «выходят из возраста» опытных образцов, и появляются мелкосерийные модели. Например, аппарат компании Organovo способен распечатать фрагменты тканей, содержащих 20 и более клеточных слоев (причем туда входят клетки разных типов), объединенных межклеточной тканью и сетью кровеносных капилляров.
 Печень До выращивания целой искусственной печени еще далеко, однако фрагменты ткани печени человека уже получены методом выращивания на матрице из биоразлагаемых полимеров. Такие имплантаты смогут помочь в восстановлении пораженных участков.
Печень До выращивания целой искусственной печени еще далеко, однако фрагменты ткани печени человека уже получены методом выращивания на матрице из биоразлагаемых полимеров. Такие имплантаты смогут помочь в восстановлении пораженных участков.
Соединительная ткань и клетки собираются воедино по той же технологии, которую используют при трехмерной печати: движущаяся головка, позиционирующаяся с микронной точностью в трехмерной сети координат, «выплевывает» в нужную точку капельки, содержащие либо клетки, либо коллаген и другие вещества. Разные производители биопринтеров сообщили, что их устройства уже способны распечатывать фрагменты кожи подопытных животных, а также элементы почечной ткани. Причем в результате удалось достичь правильного расположения клеток разных типов друг относительно друга. Правда, эпохи, когда принтеры в клиниках будут способны создавать органы разного назначения и больших объемов, придется еще подождать.

Мозг под замену
Развитие темы запчастей для человека неизбежно приводит нас к теме самого сокровенного — того, что делает человека человеком. Замена мозга — пожалуй, самая фантастическая идея, касающаяся потенциального бессмертия. Проблема, как нетрудно догадаться, в том, что мозг — похоже, самый сложный из известных человечеству материальных объектов во Вселенной. И, возможно, один из самых непонятных. Известно, из чего он состоит, но очень мало известно о том, как он работает.
 Новая кожа Новая кожа. Сотрудник лаборатории достает из ванночки полоску искусственно выращенного эпидермиса. Ткань создали в дерматологическом институте в г. Помеция, Италия, под руководством профессора Микеле де Лука.
Новая кожа Новая кожа. Сотрудник лаборатории достает из ванночки полоску искусственно выращенного эпидермиса. Ткань создали в дерматологическом институте в г. Помеция, Италия, под руководством профессора Микеле де Лука.
Таким образом, если мозг удастся воссоздать как совокупность нейронов, устанавливающих друг с другом связи, надо еще придумать, как поместить в него всю необходимую человеку информацию. Иначе в лучшем случае мы получим взрослого человека с «серым веществом» младенца. Несмотря на всю сверхфантастичность конечной цели, наука активно работает над проблемой регенерации нервной ткани. В конце концов, цель может быть и скромнее — например, восстановление части мозга, разрушенной в результате травмы или тяжелого заболевания.
Проблема искусственной регенерации мозговой ткани усугубляется тем, что мозг обладает высокой гетерогенностью: в нем присутствует множество типов нервных клеток, в частности тормозные и возбуждающие нейроны и нейроглия (буквально — «нервный клей») — совокупность вспомогательных клеток нервной системы. Кроме того, разные типы клеток определенным образом расположены в трехмерном пространстве, и это расположение необходимо воспроизвести.
 Трахея Это тот самый случай, когда технологии выращивания тканей уже работают в медицине и спасают жизни людей. Известны случаи успешной имплантации трахеи, выращенной на донорской матрице из клеток спинного мозга пациента.
Трахея Это тот самый случай, когда технологии выращивания тканей уже работают в медицине и спасают жизни людей. Известны случаи успешной имплантации трахеи, выращенной на донорской матрице из клеток спинного мозга пациента.
Нервный чип
В одной из лабораторий знаменитого Массачусетского технологического института, известного своими разработками в сфере информационных технологий, подошли к созданию искусственной нервной ткани «по-компьютерному», применив элементы технологии изготовления микрочипов.
Исследователи из Бостона взяли смесь нервных клеток, полученных из первичной коры мозга крысы, и нанесли их на тончайшие пластины гидрогеля. Пластины образовали своего рода сэндвич, и теперь задача состояла в том, чтобы вычленить из него отдельные блоки с заданной пространственной структурой. Получив такие прозрачные блоки, ученые намеревались изучать процессы возникновения нервных связей внутри каждого из них.
 Мочевой пузырь Технология пересадки человеку мочевого пузыря, выращенного на коллагеновой матрицы из мочевого пузыря или тонкой кишки животного происхождения, уже создана и имеет положительную практику применения.
Мочевой пузырь Технология пересадки человеку мочевого пузыря, выращенного на коллагеновой матрицы из мочевого пузыря или тонкой кишки животного происхождения, уже создана и имеет положительную практику применения.
Задача была решена с помощью фотолитографии. На пласты гидрогеля накладывались пластиковые маски, которые позволяли свету воздействовать лишь на определенные участки, «сваривая» их воедино. Так удалось получить разнообразные по размерам и толщине композиции клеточного материала. Изучение этих «кирпичиков» со временем может привести к созданию значимых фрагментов нервной ткани для использования в имплантах.
Если инженеры MIT подходят к изучению и воссозданию нервной ткани в инженерном стиле, то есть механически формируя нужные структуры, то в Центре биологии развития RIKEN в японском городе Кобе ученые под руководством профессора Йошики Сасаи нащупывают другой путь — evo-devo, путь эволюции развития. Если плюрипотентные стволовые клетки эмбриона могут при делении создавать самоорганизующиеся структуры специализированных клеток (то есть разнообразные органы и ткани), то нельзя ли, постигнув законы такого развития, направлять работу стволовых клеток для создания имплантатов уже с природными формами?
 Позвоночник В деле выращивания костей и хрящей на матрицах достигнут большой прогресс, однако восстановление нервной ткани спинного мозга — дело будущего.
Позвоночник В деле выращивания костей и хрящей на матрицах достигнут большой прогресс, однако восстановление нервной ткани спинного мозга — дело будущего.
И вот главный вопрос, на который намеревались найти ответ японские биологи: насколько зависит развитие конкретных клеток от внешних факторов (например, от контакта с соседними тканями), а в какой степени программа «зашита» внутри самих стволовых клеток. Исследования показали, что есть возможность вырастить из изолированной группы стволовых клеток заданный специализированный элемент организма, хотя внешние факторы играют определенную роль — например, необходимы определенные химические индуцирующие сигналы, заставляющие стволовые клетки развиваться, скажем, именно как нервная ткань. И для этого не понадобится никаких поддерживающих структур, которые придется наполнять клетками — формы возникнут сами в процессе развития, в ходе деления клеток.
В новом теле

Вопрос о пересадке мозга, коль скоро мозг является вместилищем интеллекта и самого человеческого «я», по сути, не имеет смысла, так как если мозг уничтожен, то воссоздать личность невозможно (если только со временем не научатся делать «резервные копии» сознания). Единственное, что могло бы иметь резон — это пересадка головы, а точнее — пересадка тела голове, у которой с телом проблемы. Однако при невозможности на современном уровне медицины восстановления спинного мозга, тело с новой головой останется парализованным. Правда, по мере развития тканевой инженерии, возможно, нервную ткань спинного мозга можно будет восстанавливать с помощью стволовых клеток. На время операции мозг придется резко охлаждать для предотвращения смерти нейронов.
По запатентованной Сасаи методике японцам удалось вырастить трехмерные структуры нервной ткани, первой из которых стала полученная из эмбриональных стволовых клеток мышей сетчатка глаза (так называемый зрительный бокал), которая состояла из функционально различных типов клеток. Они были расположены так, как предписывает природа. Следующим достижением стал аденогипофиз, не просто повторяющий структуру природного, но и выделяющий при пересадке мыши необходимые гормоны.

Разумеется, до полнофункциональных имплантов нервной ткани, а тем более участков человеческого мозга еще очень и очень далеко. Однако успехи искусственной регенерации тканей с применением технологий эволюции развития указывают путь, по которому пойдет вся регенеративная медицина: от «умных» протезов — к композитным имплантатам, в которых готовые пространственные структуры «проращиваются» клеточным материалом, и далее — к выращиванию запасных частей для человека по тем же законам, по которым они развиваются в естественных условиях.
ФПИ спрогнозировал научный прорыв в области выращивания тканей и органов

МОСКВА, 11 окт — РИА Новости. Российские учёные готовятся к выращиванию тканей и органов, научный прорыв в этой области может случиться в ближайшее десятилетие, заявил РИА Новости руководитель проектной группы Фонда перспективных исследований (ФПИ) Анатолий Ковтун.
«Научный прорыв состоится, если получится искусственно вырастить полностью функционально пригодный орган, способный «работать» по своему прямому назначению. Но и здесь ученых ожидает пока еще не решенная проблема – высокая вероятность отторжения искусственного органа организмом реципиента», — добавил Ковтун.
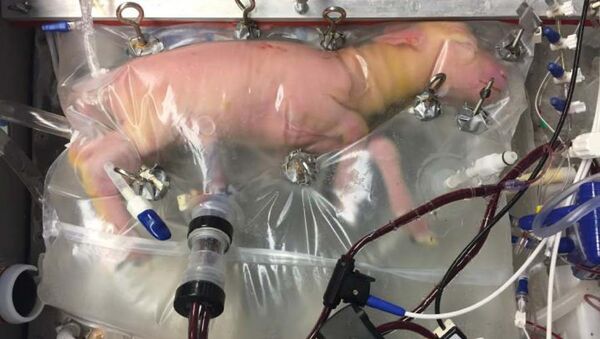
«Исследованиями возможностей выращивания тканей и органов для последующей пересадки занимаются научные коллективы по всему миру. Например, в Техасском университете в биореакторе вырастили легкие человека, правда, они не функциональны из-за отсутствия в них кровеносных сосудов. Швейцарцы смогли создать сердечные клапаны, в Австралии научились выращивать искусственные почки из стволовых клеток кожи, израильские ученые успешно вырастили и пересадили искусственные кости грызунам. В России также ведутся работы по данному направлению, есть и заметные успехи. Например, ученые Института биологии развития имени Н.К. Кольцова РАН разработали технологию получения биоинженерной искусственной кожи, которая может стать незаменимой для закрытия ожоговых ран и в ряде других случаев», — отмечает представитель ФПИ.

Фонд перспективных исследований создан в 2012 году для содействия научным исследованиям и разработкам в интересах обороны и безопасности страны. Деятельность ведется по трем основным направлениям — химико-биологическому и медицинскому, физико-техническому, информационному. В конце 2015 года в структуре ФПИ был создан Национальный центр развития технологий и базовых элементов робототехники. В настоящее время фонд работает более чем над 50 проектами, для них созданы свыше 40 лабораторий в ведущих университетах, НИИ и оборонных предприятиях.
Органы из пробирки: что уже умеют выращивать
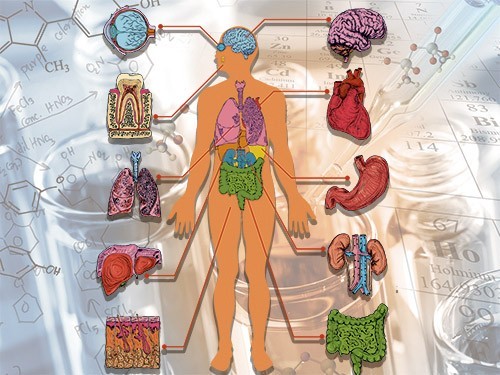
Возможность вырастить человеческий орган в пробирке и пересадить его человеку, нуждающемуся в пересадке — мечта трансплантологов. Ученые по всему миру работают над этим и уже научились делать ткани, небольшие работающие копии органов, и до полноценных запасных глаз, легких и почек нам на самом деле осталось совсем немного. Пока что органеллы используются в основном в научных целях, их выращивают, чтобы понять, как работают органы, как развиваются болезни. Но от этого до трансплантации всего несколько шагов. МедНовости собрали сведения о самых перспективных проектах.
Легкие. Ученые из Техасского университета вырастили легкие человека в биореакторе. Правда, без кровеносных сосудов такие легкие не функциональны. Однако команда ученых из Медицинского центра Колумбийского университета (Columbia University Medical Center, New York) недавно впервые в мире получили функциональное легкое с перфузируемой и здоровой сосудистой системой у грызунов ex vivo.
Ткани сердечной мышцы. Биоинженерам из университета Мичигана удалось вырастить в пробирке кусок мышечной ткани. Правда, полноценно сердце из такой ткани пока работать не сможет, она вдвое слабее оригинала. Тем не менее пока это самый сильный образец сердечной ткани.
Кости. Израильская биотехнологическая компания Bonus BioGroup использовалат трехмерные сканы для создания гелеобразного каркаса кости перед посевом стволовыми клетками, взятыми из жира. Кости, получившиеся в результате, они успешно пересадили грызунам. Уже планируются эксперименты по выращиванию человеческих костей по этой же технологии.
Ткани желудка. Ученым под руководством Джеймса Уэллса из Детского медицинского клинического центра в Цинциннати (Огайо) удалось вырастить «в пробирке» трехмерные структуры человеческого желудка при помощи эмбриональных стволовых клеток и из плюрипотентных клеток взрослого человека, перепрограммированных в стволовые. Эти структуры оказались способны вырабатывать все необходимые человеку кислоты и пищеварительные ферменты.
Японские ученые вырастили глаз в чашке Петри. Искусственно выращенный глаз содержал основные слои сетчатки: пигментный эпителий, фоторецепторы, ганглионарные клетки и другие. Трансплантировать его целиком пока возможности нет, а вот пересадка тканей — весьма перспективное направление. В качестве исходного материала были использованы эмбриональные стволовые клетки.
Ученые из корпорации Genentech вырастили простату из одной клетки. Молекулярным биологам из Калифорнии удалось вырастить целый орган из единственной клетки.
Ученым удалось найти единственную мощную стволовую клетку в простатической ткани, которая способна вырасти в целый орган. Таких клеток оказалось чуть меньше 1% от общего числа. В исследовании 97 мышам трансплантировали такую клетку под почку и у 14 из них выросла полноценная простата, способная нормально функционировать. Точно такую же популяцию клеток биологи нашли и в простате человека, правда, в концентрации всего 0,2%.
Сердечные клапаны. Швейцарские ученые доктор Саймон Хоерстрап (Simon Hoerstrup) и Дорта Шмидт (Dorthe Schmidt) из университета Цюриха (University of Zurich) смогли вырастить человеческие сердечные клапаны, воспользовавшись стволовыми клетками, взятыми из околоплодной жидкости. Теперь медики смогут выращивать клапаны сердца специально для неродившегося еще ребенка, если у него еще в зародышевом состоянии обнаружатся дефекты сердца.
Ушная раковина. Используя стволовые клетки, ученые вырастили ухо человека на спине крысы. Эксперимент был проведен исследователями из Университета Токио (University of Tokyo) И Университета Киото (Kyoto University) под руководством Томаса Сервантеса (Thomas Cervantes).
Кожа. Ученые из Цюрихского университета (Швейцария) и университетской детской больницы этого города впервые сумели вырастить в лаборатории человеческую кожу, пронизанную кровеносными и лимфатическими сосудами. Полученный кожный лоскут способен почти полностью выполнять функцию здоровой кожи при ожогах, хирургических дефектах или кожных болезнях.
Поджелудочная железа. Ученые впервые создали васкуляризованные островки поджелудочной железы, способные вырабатывать инсулин. Еще одна попытка вылечить диабет I типа.
Почки. Ученые из австралийского университета Квинсленда научились выращивать искусственные почки из стволовых клеток кожи. Пока это лишь маленькие органоиды размером 1 см, но по устройству и функционированию они практически идентичны почкам взрослого человека.
Печень. Биологи сразу нескольких стран заявили о том, что смогли вырастить полноценный аналог печени, способный очищать кровь от токсинов и выполнять другие функции этого органа. Для этого ученые использовали стволовые клетки и «заготовки» из стволовых клеток. Эти разработки параллельно велись в Японии, Америке и России.
Мочевой пузырь. Группа американских ученых под руководством Энтони Аталы (Anthony Atala) вырастила в лаборатории человеческие мочевые пузыри, полностью готовые к пересадке, из образцов собственных тканей пациентов. Те же ученые вырастили мочеиспускательные каналы для пациентов, у которых они были повреждены.
Кроме того, ученые уже научились выращивать хрящевые ткани, ткани скелетных мышц и костей, ткани гипофиза, тимуса, а также ткани, функционирующие аналогично тканям человеческого мозга.
Через 15 лет выращивание искусственных внутренних органов станет обычным делом

Российские ученые впервые в мире с помощью 3D принтера вырастили живой, действующий орган. Это щитовидная железа, которая была имплантирована лабораторной мыши. Железа прижилась успешно, вырабатывает гормоны, животное прекрасно себя чувствует.
Настоящий прорыв в области медицинских 3D технологий совершили российские специалисты компании-резидента фонда «Сколково». Они создали уникальный 3D-биопринтер, на котором можно «печатать» живые органы для трансплантации. Всего 5 компаний в мире смогли создать подобную работающую технологию. Ученые же из России стали первыми, кто превратил компьютерную 3D-идею в полную, живую реальность.
Что такое 3D-биопринтинг? Это послойное производство живых органов и компонентов из биологического материала – клеток – по компьютерной модели. Причем, сохраняется жизнеспособность и функциональность этих клеток, а значит, и органа в целом.

Как рассказал исполнительный директор кластера биологических и медицинских технологий Фонда «Сколково» Кирилл Каем, процесс создания органа на 3D-биопринтере пока что очень трудоемкий и долгий. Поскольку для каждого органа или био-компонента нужны «свои» клетки. К тому же, приходится подбирать, тестировать и применять различные алгоритмы печати.
Поэтому ученые пока не могут запустить «линию» по производству органов для трансплантации. Необходимо сначала создать технологии печати тех или иных органов. Сегодня они «нацелились» на печень и почку. Это проекты, которые будут осуществляться на лабораторном уровне.
Для отработки технологии специалисты отвели себе срок в 15 лет. В процессе создания живых био-моделей, будет совершенствоваться и сам 3D-биопринтер. В планах «Сколково» – в ближайшем будущем производство и продажа самих биопринтеров.
Первый российский 3D-биопринтер FABION был представлен в 2014 году на форуме «Открытые инновации» в Москве. Он был разработан специалистами компании 3D Bioprinting Solutions. Этот биопринтер можно применять для печати тканей сердца, кожи и кровеносных сосудов.
Однако, российским ученым потребовалось совсем немного времени, чтобы совершить настоящий прорыв.
В будущем они планируют с помощью 3D-биопечати несколько «усовершенствовать» человеческие органы, предназначенные для трансплантации. Улучшить их функции и выносливость.
Американские ученые из Института регенеративной медицины тоже разрабатывают 3D-технологии для биопечати. Сегодня они успешно могут создавать отдельные кости, хрящи, части рук и ушей. Применяются при этом стволовые клетки и специальные полимерные шаблоны.

Проблему, с которой сталкиваются специалисты, когда пытаются с помощью 3D-технологий создать живой орган, решить было очень сложно. Дело в том, что при «печати» клетки можно располагать только тонким слоем. Если толщина этого слоя превышает 200 микрометров, ткань начинает отмирать. Поскольку при отсутствии в этом материале кровеносных сосудов, кислород и питательные вещества не могут проходить на нужную глубину.
Создатели технологии смогли преодолеть эту проблему. Они изготовили специальные полимерные шаблоны. С их помощью можно «укладывать» слои клеток друг на друга так, чтобы между ними оставался крохотный просвет. Когда новый орган или биокомпонент трансплантируют в организм животного или человека, то кровеносные сосуды постепенно прорастают в эти специально оставленные просветы. Полимер тоже постепенно вытесняется растущими сосудами, разлагаясь безопасно для организма.
В результате получается полноценный орган, с кровеносной системой, нужной формы и необходимыми видами тканей.
Энтони Атала, специалист Института регенеративной медицины, заявил: «Теперь у нас есть возможность печатать полноценные человеческие органы, сохраняющие стабильность.»
Американские ученые смогли успешно подтвердить эти слова. Они создали на своем 3D-биопринтере с помощью стволовых клеток кость нижней челюсти человека. А также – вполне полноценную ушную раковину. При этом использовали в качестве модели для печати МРТ-снимок одного из добровольцев.
Эти органы были трансплантированы лаборатной мыши. Они успешно прижились , изнутри покрывшись кровеносными сосудами.
Гаральд Отт, специалист из Гарвардского университета, не применяет 3D-технологии. Хотя его методика чем-то похожа на 3D-печать. Здесь тоже используются стволовые клетки, но в качестве шаблона или каркаса – извлеченный из тела животного или человека больной орган. В частности, таким образом ученые смогли «ремонтировать» почки лаборатных животных – крыс.
Методика такова: сначала поврежденный орган обрабатывается специальным химическим составом, чтобы уничтожить клетки и оставить только «каркас» из соединительных белков. А затем через кровеносные сосуды и мочевыводящие пути наполняется стволовыми клетками. В результате получается готовый для трансплантации орган.

Таким образом ученые сумели вырастить «новые» легкие, печень и сердце. Однако, главное их достижение – это крысиная лапа. Важной задачей для ученых в этом случае было успешное восстановление мышц и кровеносных сосудов.
В специальный биореактор биологи поместили «каркас» крысиной лапы, а также стволовые клетки мышц и сосудов. Через несколько недель получили полноценный орган, полностью готовый к дальнейшему применению. Единственная проблема – это отсутствующая нервная система.

Как рассказал Гаральд Отт, при пересадке нервы, как и сосуды, могут постепенно прорастать в имплантированный орган. Это позволит человеку или животному начать ощущать новый орган, управлять им. Ученый высказал надежду, что в будущем специалистам удастся использовать эту особенность живого организма при пересадке конечностей.
Ну, а чтобы доказать, что выращенная ими крысиная лапа вполне функциональна, ученые подключили этот орган к электродам и пропустили небольшой заряд тока. Оказалось, что пальцы, суставы и мышцы искусственно выращенной конечности прекрасно двигались, как у живого животного.
В Японии биологи-специалисты Института физико-химических исследований RIKEN смогли в пробирке вырастить мышиный глаз из стволовых клеток. Это, действительно, высочайшее достижение науки. Однако, совсем недавно этим ученым удалось создать практически невозможное.
Они смогли вырастить очень важную часть человеческого глаза, можно сказать, его основу – глазной бокал. При формировании человеческого глаза сначала создается глазной пузырь из клеток эпителия. А затем одна из его стенок начинает вдавливаться, и образуется глазной бокал. Дно и стенки этой части глаза выложены специальными рецепторами и проводящими клетками. Этот компонент очень важен для зрительного восприятия.

Диаметр глазного бокала человека составляет 550 мкм. Он в два раза больше мышиного. Вырастить его было очень непросто, процесс долгий. Ученые сильно опасались, что такая сложная структура не вырастет сама по себе из стволовых клеток. Однако, их опасения не оправдались. Природа мудра, в ДНК стволовых клеток заложена вся необходимая информация. И трехмерная структура глазного бокала выросла-таки сама по себе, без постороннего вмешательства.
Самое потрясающее то, что по ходу эксперимента ученые усовершенствовали саму технологию выращивания органов из стволовых клеток. Ранее применение стволовых клеток всегда сопровождалось риском формирования различного рода опухолей, в том числе онкологических. Однако, японским ученым удалось выращивать в пробирке фоторецепторную ткань именно из соответствующих стволовых клеток, избегая захвата других клеток, отвечающих за рост иных тканей.
Эксперимент продолжается, исследователи продолжают выращивать фоторецепторную ткань глаз и пересаживать ее лабораторным мышам. У них впереди еще долгий путь, но надежда для очень многих слепых и слабовидящих людей во всём мире всё-таки появилась…
И, наконец, английские ученые недавно заявили, что недалек тот день, когда человечество будет избавлено от зубной боли!

У людей новые здоровые зубы смогут расти сами. Специалисты обнаружили сразу 400 генов, ответственных за полное восстановление зубов у акул. Аналогичные гены есть и у человека. У людей эти гены становятся неактивными после выпадения молочных зубов и роста новых.
Ученые ведут исследования, которые помогут им понять, как можно будет активизировать гены, ответственные за рост зубов. И на основе этого механизма создать соответствующую медицинскую технологию. Причем, как считают английские ученые, новые зубы у человека можно будет вырастить за… сутки.
Искусственные органы и ткани человека
Идеи о замене больных органов здоровыми возникли у человека еще несколько веков назад. Но несовершенные методы хирургии и анестезиологии не позволяли осуществить задуманное. Поэтому в современном мире трансплантация органов заняла достойное место в лечении терминальных стадий многих заболеваний. Были спасены тысячи человеческих жизней. Но проблемы возникли с другой стороны. Катастрофический дефицит донорских органов, иммунологическая несовместимость и тысячи людей в листах ожидания того или иного органа, которые так и не дождались своей операции.
Ученые всего мира все чаще задумывались над созданием искусственных органов, которые могли бы заменить настоящие по своим функциям.
В начале XXI века возникли предпосылки появления принципиально новых подходов к восстановлению функций жизненно важных органов, основанных на технологиях клеточной и тканевой хирургии.
Создание искусственных органов и тканей оформилось в самостоятельную отрасль науки около десяти лет тому назад. Нам известны искусственные почка, легкие, сердце, кожа, кости, суставы, сетчатка, кохлеарные импланты. Идеальный искусственный орган должен соответствовать следующим параметрам:
– его можно имплантировать в организм человека;
– он не имеет сообщения с окружающей средой;
– изготовлен из легкого, прочного, обладающего высокой биологической совместимостью материала;
– долговечный, выдерживающий большие нагрузки;
– полностью моделирует функции естественного аналога.
Первые достижения этого направления – создание искусственной кожи, образцы уже проходили клинические испытания в центрах трансплантации. Выращивание хрящевой ткани занимает, к сожалению, много времени — несколько недель, поэтому ученые пытаются разработать методики более быстрого получения искусственных тканей. Всероссийская заочная научная конференция для молодых ученых, студентов и школьников «Актуальные вопросы биомедицинской инженерии» «Группа экспериментаторов из биотехнологической компании «Organogenesis» провела выращивание пленки искусственной кожи на матриксе из природного коллагена, что позволяет практически сразу использовать эту новую ткань в клинике. При клиническом испытании нового кожного трансплантата было показано, что он улучшает (не менее чем на 60% по сравнению с обычными материалами) заживление венозных язв и кожных повреждений. Два года назад «Лучшим инновационным продуктом» России была признана биокожа, разработанная врачом из Оренбурга Рамилем Рахматулиным. И вот теперь на предприятии при Оренбургском госуниверситете начали её производство. Биокожа –это материал, заживляющий раны после ожогов или травм. Он не вызывает отторжения, его можно долго хранить, а главное –не нужно снимать с раны после заживления. А применяемые в производстве нанотехнологии позволяют
избежать химических примесей в готовом продукте.
Медики уже заинтересовались биоматериалом, его ждут в больницах и ожоговых центрах страны. Биокожу будут выпускать в упаковках, для начала –1,5 тыс. штук в месяц»
Одно из последних достижений состоит в конструировании хрящевой ткани, способной к активной регенерации. Это действительно огромный успех, поскольку поврежденная суставная ткань не регенерирует в организме.
В клиниках США ежегодно оперируют более 500 тыс. больных с повреждениями суставного хряща, но подобное хирургическое вмешательство лишь на короткое время облегчает боль и улучшает движения в суставе. Ученые из Гётеборгского университета в Швеции экстрагировали хондроциты (клетки хряща) из суставов 23 пациентов, вырастили культуру клеток, которая образовала хрящевую ткань, а затем имплантировали ее в поврежденный коленный сустав. Результат оказался превосходным: у 14 из 16 пациентов было отмечено практически полное замещение поврежденного хряща новой тканью в месте ее имплантации. Выращивание хрящевой ткани занимает, к сожалению, много времени — несколько недель, поэтому ученые пытаются разработать методики более быстрого получения искусственных тканей. Однако кожа и хрящ –ткани, состоящие из одного или двух типов клеток, и требования к структуре основы, предназначенной для их выращивания в искусственных условиях, относительно невысоки. Со многими же другими органами дело обстоит гораздо сложнее. В настоящее время предпринимаются попытки выращивания в лабораторных условиях печени.
Печень – сложно устроенный орган, состоящий из разных типов клеток, обеспечивающих очищение крови от токсинов, преобразование поступивших извне питательных веществ в усваиваемую организмом 10 октября –16 декабря 2011г. форму и выполняющих целый ряд других функций. Поэтому создание искусственной печени требует гораздо более сложной технологии: все эти разнообразные типы клеток должны быть размещены строго определенным образом, то есть основа, на которой они базируются, должна обладать высокой избирательностью.
С этой целью на такую синтетическую основу наносятся молекулы, обладающие свойствами клеточной адгезии и межклеточного узнавания — функциями установления специфических межклеточных связей в организме. История создания такой подложки для клеток печени может служить иллюстрацией преимуществ комбинированной технологии. Например, исследователям из Массачусетского технологического института удалось создать подложку, на которой закрепляются только клетки-гепатоциты. Хорошо известно, что клетки этого типа выполняют в организме больше метаболических функций, чем любые другие. Одной из таких функций является удаление из кровеносного русла поврежденных белков. Гепатоциты узнают эти белки по определенным углеводным последовательностям, которые и «маркируют» их как брак. Исследователи синтезировали молекулы с такой последовательностью звеньев и «прикрепили» их к искусственному полиакриламидному полимеру, полагая, что эти «приманки» будут избирательно «привлекать» гепатоциты. Действительно, гепатоциты узнавали метки и задерживались на поверхности полимера. Однако впоследствии оказалось, что полиакриламид не может служить подходящим материалом для
искусственной печени, поскольку вызывает сильную иммунную реакцию со стороны организма. Необходимо было искать какой-то другой полимер, который бы не отторгался организмом, но при этом и не адсорбировал бы различные белки, которые, осев на полимере, тут же начинали бы привлекать все типы клеток без разбора. В конце концов старания ученых увенчались определенным успехом. Им удалось синтезировать сетчату подложку из полиэтилен-оксида (ПЭО), не вызывающего иммунной реакции и не адсорбирующего белки. ПЭО представляет собой молекулу звездчатой формы, лучи которой расходятся в разные стороны от плотного центрального ядра. Когда молекулы ПЭО связываются между собой, концы лучей каждой «звезды» свободно плавают в водном растворе. При этом они несут на себе реактивные гидроксильные группы, к которым иприкрепляют углеводные «приманки» для гепатоцитов. Было показано, что при добавлении в такой раствор гепатоцитов крысы они тут жесвязываются с углеводами и закрепляются на сетчатой подложке, в то время как фибробласты, внесенные в раствор, на полимере не оседают.
Таким образом, ученым посчастливилось разрешить одну из самых больших проблем в создании искусственных органов: сконструировать высокоспецифический клеточный акцептор. Следующим этапом стало Всероссийская заочная научная конференция для молодых ученых, студентов и школьников «Актуальные вопросы биомедицинской инженерии» формирование трехмерной структуры сетчатой подложки. Здоровая печень
состоит из массы клеток, пронизанных сложной сетью кровеносных сосудов. Для нормальной работы печени различные типы клеток должны быть расположены по отношению друг к другу в определенном порядке. Разработав способ укладки полимера (полиактиновой кислоты) на тончайшую бумажную основу под управлением компьютера, что позволяет в дальнейшем конструировать уже трехмерную архитектуру органа, исследователи теперь бьются над проблемой соединения с трехмерной структурой нового полимера молекул ПЭО, несущих «приманки». В будущем они надеются присоединить к полимеру и метки другого типа, например антитела, привлекающие к себе клетки, образующие желчные протоки. Наконец, предполагается использование аминокислот — глютаминовой, аспарагиновой и аргинина — для
формирования специфического эндотелиального слоя печени. Так постепенно, шаг за шагом, ученые надеются создать полноценную искусственную печень.
Гибридные основы-подложки хорошо зарекомендовали себя и в экспериментах по «выращиванию» нервных волокон. В этом случае в качестве подложки оказался особенно эффективен тефлон — материал, совершенно безвредный для организма. Соединение тефлоновой сетки с молекулами ламинина посредством модифицированных ионизированным газом атомов никеля представляет собой, по мнению исследователей, весьма перспективную основу, на которой может происходить рост
отростков нервных клеток. Ламинин в данном случае выполняет функцию
регуляции и направления роста нервов. Следующим шагом,
приближающим клиническое применение индуцированного роста предназначенных для трансплантации нервов, должно стать изготовление специальных направляющих трубочек, которые можно было бы размещать в организме вдоль поврежденных нервных волокон. Соединение тефлоновой сетки с молекулами ламинина посредством модифицированных ионизированным газом атомов никеля представляет собой, по мнению исследователей, весьма перспективную основу, на которой может происходить рост отростков нервных клеток. Ламинин в данном случае выполняет функцию регуляции и направления роста нервов.
Следующим шагом, приближающим клиническое применение индуцированного роста предназначенных для трансплантации нервов, должно стать изготовление специальных направляющих трубочек, которые можно было бы размещать в организме вдоль поврежденных нервных волокон. Тефлон также давно используют в искусственных кровеносных сосудах. Однако до сих пор из него производят только широкие (более 6 мм в диаметре) сосуды, так как сосуды меньшего диаметра через 1-2 года после имплантации закупориваются тромбоцитами и гладкомышечными 10 октября –16 декабря 2011г. клетками. Этого не происходило бы, если бы структура стенок имплантированного сосуда была похожа на выстилающий эпителий настоящих вен и артерий. Проблему можно решить путем нанесения на полимер естественных эпителиальных клеток, образующих гладкую выстилку
внутренних стенок сосудов, к которой не прилипают тромбоциты и гладкомышечные клетки. Создание такого искусственного эпителия и является основной проблемой конструирования кровеносных сосудов. К слову сказать, аналогичное налипание клеток, и как следствие, закупоривание сосудов, происходит и в самом организме из-за атеросклеротического изменения эпителия. При решении этой задачи, как и при попытках вызвать направленный рост нервных волокон, ученые пользуются «услугами» белков межклеточной адгезии и внеклеточного матрикса: фибронектина и ламинина. Среди органов и тканей, которые в настоящее время интенсивно исследуются с целью их биотехнологического воссоздания, можно отметить также костную ткань, сухожилия, кишечник, сердечные клапаны, костный мозг и трахею.
Один из самых необходимых искусственных органов –это почка.
Основной функцией искусственной почки является очищение от токсичных веществ, в основном продуктов метаболизма, не изменяя при этом объём крови в пределах организма. В настоящее время сотни тысяч людей в мире для того, чтобы жить, должны регулярно получать лечение гемодиализом. Гемодиализ –это ежедневное подключение к аппарату «искусственная почка», который был создан в 1913 г. в США, учёным Дж. Абелем, аппарат для диализа. Беспрецедентная «машинная агрессия», необходимость соблюдать диету, принимать медикаменты, ограничивать прием жидкости, потеря работоспособности, свободы, комфорта и различные осложнения со стороны внутренних органов сопровождают эту терапию. Изначально в устройстве аппарата в качестве полупроницаемой мембраны, использовались трубочки из коллодия, предназначенные для тока крови. Однако, данный материал оказался довольно хрупким и поэтому в дальнейшем учёные опробовали множество заменителей, среди которых был даже кишечник птиц, плавательный пузырь рыб, брюшина телят, тростник, бумага и т.д. В работу также была задействована и медицинская пиявка, в слюне которой содержится гирудин – вещество предотвращающее свёртывание крови. В 1925г. Дж. Хаас впервые испробовал аппарат на человеке. 1926г. в эксперименте проводимом Х. Нехельсон и Р. Лимом, на
замену гирудину, как выяснилось, оказывающему не желательный побочный эффект, приходит гепарин. В 1944г. голландский учённый В. Колфф и Х. Берка появилось два основных типа диализатора: катушечный, где использовали трубки из Всероссийская заочная научная конференция для молодых ученых, студентов и школьников «Актуальные вопросы биомедицинской инженерии» целлофана, и плоскопараллельный, в котором применялись плоские мембраны.
Группа ученых из Калифорнийского университета в Сан-Франциско разработали и в 2010 году применили на практике гемодиализный аппарат, имплантируемый в организм больного. Данное изобретение отличается компактностью (по размеру не больше человеческой почки) и снижает до минимума уровень возможных неудобств при ее вживлении. Аппарат состоит из ряда микрофильтров, биореактора с культурой клеток почечных канальцев, отвечающих за метаболические функции почки. Прибор работает за счет давления крови, т. е. не требует энергообеспечения.
Полимерный носитель обеспечивает обратную реабсорбацию (всасывание) воды и усвоение полезных веществ, приближая действие имплантанта, насколько это возможно, к принципу работы настоящей почки. Подобная модель по своей функциональности ничем не уступает донорской почке, что позволяет не прибегать к трансплантации человеческого органа.
Принципы создание искусственного сердца были разработаны в СССР В.П. Демиховым ещё в 1937г. С течением времени это устройство претерпело колоссальные преобразования в размерах и способах использования.
Искусственное сердце представляет собой технологическое устройство, предназначенное для поддержания достаточных для жизнедеятельности параметров гемодинамики. В настоящее время под искусственным сердцем понимается две группы технических устройств. К первой относятся гемооксигенаторы, также их называют аппараты искусственного кровообращения. Они состоят из артериального насоса, перекачивающего кровь, и блока оксигенатора, который насыщает кровь кислородом. Данное оборудование активно используется в кардиохирургии, при проведении операций на сердце. Ко второй относятся кардиопротезы, то есть технические устройства, имплантируемые в организм человека, призванные заменить сердечную мышцу и повысить качество жизни больного. Следует отметить, что в настоящее время данные устройства являются лишь экспериментальными и проходят клинические испытания.
В 2009 году еще не было создано эффективного имплантируемого человеку протеза всего сердца. Ряд ведущих кардиохирургических клиник проводит успешные частичные замены органических компонентов на искусственные. Например, производится замена клапанов, крупных сосудов, предсердий, желудочков. Также следует отметить, что вполне успешно производится пересадка донорского сердца. По состоянию на 2010 год существуют прототипы эффективных имплантируемый искусственно человеку протезов всего сердца. В центре имени Бакулева 26 марта 2010 года была произведена операция по полной 10 октября –16 декабря 2011г. замене сердца человека на искусственный аналог кардиохирургом Лео Бокерия, совместно с его американским коллегой. Данный аппарат обеспечивает адекватное кровоснабжение органов и тканей пациента, главным его недостатком является наличие аккумулятора весом в 10 кг, нуждающимся в перезарядке каждые 12 часов. В настоящее время данные протезы рассматриваются как временная мера позволяющая пациенту с тяжелой сердечной патологией дожить до момента пересадки сердца. Помимо работ по созданию искусственных органов и тканей человеческого организма ученые продолжают разрабатывать и методы вживления в организм больных диабетом людей клеток, продуцирующих инсулин, а людям, страдающим болезнью Паркинсона, — нервных клеток, синтезирующих нейромедиатор дофамин, что позволит избавить пациентов от ежедневных утомительных инъекций.
Инновации и модернизация –модные нынче темы. О них часто говорят первые лица страны и их окружение. И хотя скептики уверяют, что инновации в России невозможны, в институтах и научных центрах идёт обычная текущая работа, в результате которой на свет появляются интересные проекты и разработки. И выясняется, что модернизировать есть что.
Дата добавления: 2015-08-05 ; просмотров: 42 ; Нарушение авторских прав
